
����Ŀ��������һ������������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��1��ֱ���ȷֽⷨ���⡣ij�¶�����H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=_____��
O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=_____��
��2���Ҵ�ˮ�����������⡣�䲿�ַ�Ӧ���̺ͷ�Ӧ��ƽ�ⳣ�����¶ȱ仯������ͼ1��ʾ��

��Ӧ����ij�¶���ÿ����1mol H2(g) �����仯��62 kJ������¶���ͼ1��ʾ��Ӧ���Ȼ�ѧ����ʽ��______________________________________��
��3��ˮú�������⡣CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H <0���ڽ�����[n(CO)��n(H2O)]��ͬʱ�������Ӧ��CO��ƽ��ת���ʼ�ͼ2�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ����
CO2(g)+H2(g) ��H <0���ڽ�����[n(CO)��n(H2O)]��ͬʱ�������Ӧ��CO��ƽ��ת���ʼ�ͼ2�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ����

����ά�ֺ��µ�2L�ܱ������м���һ������CO��0.lmol H2O(g)����ͼ��G���Ӧ�¶��·�Ӧ��5min �ﵽƽ������v(CO) ����_________mol/(L��min)
��ͼ��B��E �����Ӧ�ķ�Ӧ�¶ȷֱ�ΪTB��TE�ж���TB______TE ���<����=����>������
����������A��E ��G�����Ӧ�ķ�Ӧ�¶ȶ���ͬΪT�棬��ԭ����A��E ��G�����Ӧ��_____________��ͬ��
����T��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����3.0 mol CO��1.0 mol H2O��1.0mol CO2��x mol H2��Ҫʹ������Ӧ��ʼʱ������Ӧ�����������xӦ�����������_________________________________��
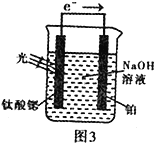
��4����绯ѧ�ֽ����⡣��ԭ����ͼ3�������ȹ�缫�ĵ缫��ӦΪ��4OH--4e-![]() O2+2H2O
O2+2H2O
�缫�ĵ缫��ӦΪ_______________________________��
��5��Mg2Cu��һ�ִ���Ͻ�350��ʱ��Mg2Cu��H2��Ӧ������Mg2Cu�ͽ���һ�ֽ���Ԫ�ص��⻯�������������������ԼΪ0.077����Mg2Cu��H2��Ӧ�Ļ�ѧ����ʽΪ___________________________��
���𰸡� K=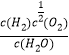 CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1 0.006 > ��ѧƽ�ⳣ������K�� 0��x��3����x<3Ҳ���֣� 2H2O+2e-==H2��+ 2OH- 2Mg2Cu +3H2
CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1 0.006 > ��ѧƽ�ⳣ������K�� 0��x��3����x<3Ҳ���֣� 2H2O+2e-==H2��+ 2OH- 2Mg2Cu +3H2![]() MgCu2+3MgH2
MgCu2+3MgH2
����������1��ij�¶��£�H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=
O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=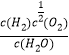 ����2������ͼ����Ϣ��֪����ӦΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g)�������¶�Kֵ����˵��ƽ��������Ӧ�����ƶ�������Ӧ��ת���ȷ�Ӧ��ij�¶���ÿ����1mol H2(g) �����仯��62 kJ������H=+��62
����2������ͼ����Ϣ��֪����ӦΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g)�������¶�Kֵ����˵��ƽ��������Ӧ�����ƶ�������Ӧ��ת���ȷ�Ӧ��ij�¶���ÿ����1mol H2(g) �����仯��62 kJ������H=+��62![]() 4��kJ��mol-1=+248kJ��mol-1�����ȷ�Ӧ����ʽΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1��(3) ����ά�ֺ��µ�2L�ܱ������м���һ������CO��0.lmol H2O(g)����ͼ��G�������[n(CO)��n(H2O)]=1.5����ʼʱn(CO)= 0.l5mol��CO��ƽ��ת����Ϊ40%�������ĵ�CO�����ʵ���Ϊ0.06mol����Ӧ�¶��·�Ӧ��5min �ﵽƽ������v(CO) ����
4��kJ��mol-1=+248kJ��mol-1�����ȷ�Ӧ����ʽΪCH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ��H=+248kJ��mol-1��(3) ����ά�ֺ��µ�2L�ܱ������м���һ������CO��0.lmol H2O(g)����ͼ��G�������[n(CO)��n(H2O)]=1.5����ʼʱn(CO)= 0.l5mol��CO��ƽ��ת����Ϊ40%�������ĵ�CO�����ʵ���Ϊ0.06mol����Ӧ�¶��·�Ӧ��5min �ﵽƽ������v(CO) ����![]() =0.006mol/(L��min)������֪��ӦCO(g)+H2O(g)
=0.006mol/(L��min)������֪��ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H <0Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ���CO��ת���ʼ�С��ͼ��B��E�����Ӧ�ķ�Ӧ���¶ȷֱ�ΪTB��TE������Ľ�����[n(CO)��n(H2O)]E��Ĵ�CO��ת������ȣ�˵��ˮ��ת����E��Ĵ��൱��ƽ�������ƶ�����Ӧ��Ϊ�����¶ȣ�TB>TE��������4������װ��ͼ�еĵ���������������缫��ԭ�����������Һ�������ӵõ����������������缫��ӦΪ��2H2O+2e-=H2��+2OH-����5����Mg2Cu��ΪMgCu2����֪Mg�����½��������������⻯�������һ�ֽ���Ԫ�ر�ΪMg���ٸ������������������Ϊ0.077����Mg��H���ʵ���֮��Ϊ
CO2(g)+H2(g) ��H <0Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ���CO��ת���ʼ�С��ͼ��B��E�����Ӧ�ķ�Ӧ���¶ȷֱ�ΪTB��TE������Ľ�����[n(CO)��n(H2O)]E��Ĵ�CO��ת������ȣ�˵��ˮ��ת����E��Ĵ��൱��ƽ�������ƶ�����Ӧ��Ϊ�����¶ȣ�TB>TE��������4������װ��ͼ�еĵ���������������缫��ԭ�����������Һ�������ӵõ����������������缫��ӦΪ��2H2O+2e-=H2��+2OH-����5����Mg2Cu��ΪMgCu2����֪Mg�����½��������������⻯�������һ�ֽ���Ԫ�ر�ΪMg���ٸ������������������Ϊ0.077����Mg��H���ʵ���֮��Ϊ![]() ��
��![]() ������ѧʽΪMgH2����Ӧ�Ļ�ѧ����ʽΪ��2Mg2Cu��3H2
������ѧʽΪMgH2����Ӧ�Ļ�ѧ����ʽΪ��2Mg2Cu��3H2![]() MgCu2��3MgH2��
MgCu2��3MgH2��


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.������(H3PO2) ��һ�־�ϸ������Ʒ�����н�ǿ��ԭ��:
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ_____________��
��2��H3PO2 ��NaH2PO2 ���ɽ���Һ�е�Ag+��ԭΪ�����Ӷ������ڻ�ѧ����������H3PO2 ���л�ѧ������Ӧ�У�����������ΪH3PO4 ʱ���������뻹ԭ�������ʵ���֮��Ϊ_____.
��.��ҵ�ϲ�����������ȥ��������(��Ҫ�ɷ�ΪFe2O3��FeO��SiO2��Al2O3,��������������)����ȡ��ˮ����������(FeSO4��7H2O),������ͼ:

��3����ԭʱ���Լ�X ��ѡ��SO2����Ӧ�����������__________(�ѧʽ)��
��4���ӷ���������������Һ�еõ���Ʒ��Ӧ���еIJ�����_____��______�����ˡ�ϴ�ӡ����
��5����ˮ����������(FeSO4��7H2O) ��ҽѧ�ϳ�������Ѫ����ij����С��ͨ������ʵ�鷽���ⶨij��Ѫ�����������ӵĺ�����
����a: ȡ10Ƭ��Ѫ����Ʒ��ȥ���¡���ĥ���ܽ⡢���ˣ�����Һ���250mL ��Һ;
����b: ȡ������Һ25mL ����ƿ�У���������ϡ�����ữ���μ�0.010mol/L ��KMnO4
��Һ����ǡ����ȫ��Ӧ����¼���ĵ�KMnO4 ��Һ�����(�ٶ�ҩƷ�������ɷֲ���KMnO4 ��Ӧ)�������ķ�ӦΪ:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
����c: �ظ�������b��2~3 �Σ�ƽ������KMnO4 ��Һ20.00mL��
�ٲ���a ��������Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬����Ҫ____��____��
�ڸò�Ѫ�����������ӵĺ���Ϊ__________mg/Ƭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ýྻ���ձ�ȡ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ��뱥�͵�FeCl3��Һ��������У�����Һ�ʺ��ɫֹͣ���ȡ�
��д���÷�Ӧ����ʽ________________________________________��
��֤���÷�ɢϵ�ǽ������ʵ���������________________________��
��2�����ڷ�Ӧ2CO��O2=2CO2���ڱ�״���£�4.48 Lһ����̼������������������Ӧ�����ɵĶ�����̼���Ӹ�����__________________��
��3������һ��Ȫˮ��Ʒ��1.0 L����Ȫˮ����4.8��10-2 g Mg2+����ô����Ȫˮ��Mg2+�����ʵ���Ũ����_______________����1.0 mol Mg2+������Ȫˮ�������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д���������ǣ� ��
A.Fe3+��Na+��Cl����OH��
B.Fe3+��Cl����K+��Ca2+
C.Cl����Ca2+��Mg2+��CO32��
D.Ba2+��K+��CO32����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ�����С��������һ�ִӷϾɵĺ�������(��Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO�ȣ����������¹��ա�������������ͼ��
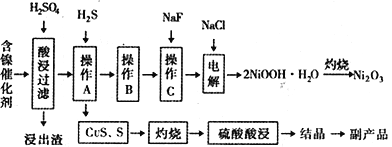
�ش�����������
��1����������Ҫ�ɷ�ΪCaSO4����2H2O��_______________�������ʡ�
��2����ͼ��ʾ���Ľ��������¶ȵĹ�ϵ���������¶ȸ���70��ʱ�����Ľ����ʽ�������������Ni(OH)2����������ԭ����_____________________________��
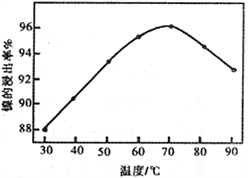
��3�����������еġ�����Ʒ��Ϊ________���ѧʽ����
��4����֪�й��������↑ʼ�����ͳ�����ȫ��pH ���±���
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.7 | 9.7 | 9.2 |
����B��Ϊ�˳�ȥ��Һ�е���Ԫ�أ�ijͬѧ���������ʵ�鷽���������A���õ���Һ�м���NaOH��Һ��������ҺpHΪ3.7��7.7�����ã����ˡ���Ը�ʵ�鷽���Ƿ���ȷ�����жϲ����������� ___________________________________����ԭ������ȷ����˵�����ɣ���ԭ������������Ը�������
��5������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10-3mol��L-1������Һ��![]() =________________��������ʱ��Ksp(CaF2)=2.7��10-11��
=________________��������ʱ��Ksp(CaF2)=2.7��10-11��
��6��������2NiOOH��H2O��ԭ����������
�ټ���������Cl-������������ΪClO-������1mol ClO-������OH-______________mol��
��Ni2+��ClO-��������2NiOOH��H2O��������ò���Ӧ�����ӷ���ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ���ǣ���
A.Al2O3�۵�ߣ����������²���
B.NH4HCO3�����ֽ⣬����������
C.Fe2(SO4)3������ˮ����������ˮ��
D.SO2���������ԣ�������Ư��ֽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����±����Ҫ�ɷ�Ϊ��IIA��Ԫ�ص��Ȼ�����Ȼ���Ϊ
A. A1Cl3 B. CuCl2
C. FeCl3 D. MgCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú����Ҫ�Ļ�ʯȼ�Ϻͻ���ԭ�ϣ��й�ú���ۺ����õõ��㷺������о�������ú��������ú���ۺ����õ���Ҫ;����
ú�Ĵ���������CO,��Ҫ��ӦΪ��C(s)+CO2(g)![]() 2CO(g)��H
2CO(g)��H
�����������ʾ������Խ�Ĵ����ܡ�Mckee��Chatterji��1975��������ɼ������������ԭѭ���������ݻ�����
��K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) ��H1=+899.4kJ/mol
2K(g)+3CO(g) ��H1=+899.4kJ/mol
��2K(g)+CO2(g)![]() K2O(s)+CO(g) ��H2=-98.4k/mol
K2O(s)+CO(g) ��H2=-98.4k/mol
��K2O(s)+CO2(g)![]() K2CO3(s) ��H3=-456.0kJ/mol
K2CO3(s) ��H3=-456.0kJ/mol
(1)��H=_____________��
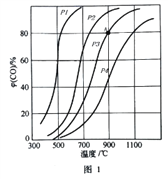
(2)��2L���ܱ�������Ͷ��3molC��3molCO2,�ڴ����������·�����Ӧ�٣�ƽ��ʱCO���������������(CO)���¶Ⱥ�ѹǿ�ı仯������ͼ1��ʾ������ͼ��ش����⣺
�������¶�Ϊ900��,ѹǿΪP�������£�����10min��Ӧ�ﵽƽ�⣬��0��10min�ڵķ�Ӧ����v(CO)Ϊ_____________��
�ڸÿ��淴Ӧ�ﵽƽ��״̬�ı�־��_____________ (����ĸ)
A��v(CO)��=2v(CO2)�� B��CO2��CO��Ũ��֮��Ϊ1��2
C�������ڵ���ѹǿ������ʱ����仯 D�����������ܶȲ�����ʱ����仯
��ͼ��ѹǿ�Ĵ�С˳��_______________���ж�������_______________��
�ܿ��淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹ����ƽ��Ũ�ȼ���(��ѹ=��ѹ�����ʵ�������)����Ӧ����ͼ��A�����ѹǿΪ1MPa,��A���ƽ�ⳣ��Kp=_____________��
(3)��ʯȼ��ȼ���������Ⱦ����ʪʽ���շ����������ռ���SO2������Ӧ�Ӷ��ﵽȼ�������Ŀ�ġ������ʺ����÷����ռ�����___________(�����)��
A����ˮ B��Na2SO4��Һ C��Na2CO3��Һ D��NaHSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɫ��ĩ����DZˮͧ����Ϊ��������Դ������������������������ͼ��ʾת����ϵ��������գ�
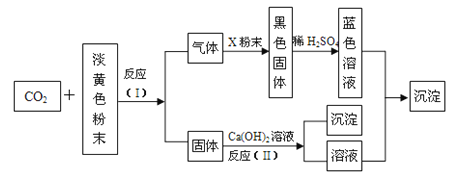
��1���õ���ɫ��ĩΪ__________________��
��2��X��ĩ�����ƻ�ѧʽΪ__________________��
��3����Ӧ��I���Ļ�ѧ����ʽΪ______________________________��
��4����Ӧ��II���Ļ�ѧ����ʽΪ_____________________________��
��5����Ӧ���Ļ�ѧ����ʽΪ______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com