
【题目】煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO,主要反应为①C(s)+CO2(g)![]() 2CO(g)△H
2CO(g)△H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(1)△H=_____________。
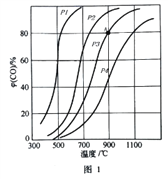
(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图像回答问题:
①若在温度为900℃,压强为P的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________,判断理由是_______________。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________。
(3)化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________(填序号)。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
【答案】 +172.5kJ/mol 0.2mol/(L·min) A、C、D p1<p2<p3<p4 理由:该反应的正反应方向是气体体积增大的方向,增大压强平衡向逆反应方向进行,CO的气体体积分数减少 3.2MPa A、C
【解析】(1)②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(②+③+④)/2 得目标反应C(s)+CO2(g)![]() 2CO(g) 所以△H =(△H1+△H2+ △H3)/2 = +172.5kJ/mol.答案:+172.5kJ/mol。
2CO(g) 所以△H =(△H1+△H2+ △H3)/2 = +172.5kJ/mol.答案:+172.5kJ/mol。
(2) C(s) + CO2(g) ![]() 2CO(g)
2CO(g)
初始量 3mol 3molCO2 0
变化量 X X 2X
平衡量 3-X 3-X 2X
由图像可知温度为900℃,时CO(g)气体的体积分数为80![]() 所以2X/(3-x+2x)x100
所以2X/(3-x+2x)x100![]() =80
=80![]()
X=2mol,0~10min内的反应速率v(CO)为2mol/(2Lx10min)= 0.2mol/(L·min).答案:0.2mol/(L·min)。
②A.v(CO)正=2v(CO2)逆 因为C(s)+CO2(g)![]() 2CO(g) 所以A可以判断达到平衡的依据, B.CO2和CO的浓度之比为1∶2,不能作为判断平衡的依据;C.容器内的总压强不再随时间而变化,因两边计量数不等,所以 C可以作为判断平衡的依据; D.混合气体的密度不再随时间而变化,因为反应物有固体参加,所以D能作为判断平衡的依据;答案:A C D。
2CO(g) 所以A可以判断达到平衡的依据, B.CO2和CO的浓度之比为1∶2,不能作为判断平衡的依据;C.容器内的总压强不再随时间而变化,因两边计量数不等,所以 C可以作为判断平衡的依据; D.混合气体的密度不再随时间而变化,因为反应物有固体参加,所以D能作为判断平衡的依据;答案:A C D。
③C(s)+CO2(g)![]() 2CO(g) △H =+172.5kJ/mol.为吸热反应,温度升高,平衡正向移动,正反应是气体体积增加方向,所以压强的大小顺序p1<p2<p3<p4 。判断理由是该反应的正反应方向是气体体积增大的方向,增大压强平衡向逆反应方向进行,CO的气体体积分数减少 。
2CO(g) △H =+172.5kJ/mol.为吸热反应,温度升高,平衡正向移动,正反应是气体体积增加方向,所以压强的大小顺序p1<p2<p3<p4 。判断理由是该反应的正反应方向是气体体积增大的方向,增大压强平衡向逆反应方向进行,CO的气体体积分数减少 。
④A点CO的体积分数为80![]() ,反应体系中的总压强为1MPa,CO的分压=总压×物质的量分数=0.8 MPa A点的平衡常数Kp=(0.8 MPa)2/(1-0.8) MPa= 3.2MPa.答案:3.2MPa。
,反应体系中的总压强为1MPa,CO的分压=总压×物质的量分数=0.8 MPa A点的平衡常数Kp=(0.8 MPa)2/(1-0.8) MPa= 3.2MPa.答案:3.2MPa。
(3) A.氨水可以和SO2反应,,故a正确;B B.Na2SO4溶液 D.NaHSO4溶液与SO2不反应,故B D不行;二氧化硫与亚硫酸钠溶液反应生成亚硫酸氢钠,反应方程式为:![]() ═
═![]() ,故C正确;;因此,本题正确答案是:A、B、C。
,故C正确;;因此,本题正确答案是:A、B、C。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:

反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。

①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
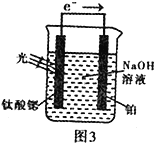
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e-![]() O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D 表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
![]()
A.Cl2+2OH-=Cl-+ClO-+H2O
B.Cu2++2OH-=Cu(OH)2↓
C.Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
D.OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取1.43g Na2CO3·10H2O溶于水配成100mL溶液,求:Na2CO3物质的量浓度________,取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积_________(设稀释时,对溶液体积的影响忽略不计)
(2)用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL0.5mol/L的稀H2SO4,所需浓H2SO4的体积为__________,如果实验室有10mL、20mL、50mL量筒,应选用___________mL量筒,定容时俯视刻度线测定结果会____________________(填偏高、偏低、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据各地报纸报导,在一些建筑工地的食堂里,常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐对人有致癌作用。这种盐的化学式是:
A. MgCl2 B. NaCl C. NaNO2 D. NaNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com