
【题目】下列物质属于共价化合物的是
A.CaOB.CO2C.K2OD.NaCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A.9种 B.6种 C.5种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验科研小组研制了一种从废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)回收镍的新工艺。工艺流程如下图:
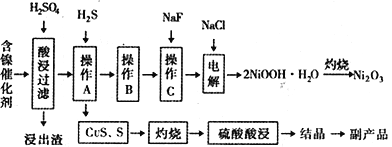
回答下列问题:
(1)浸出渣主要成分为CaSO4↓·2H2O和_______________两种物质。
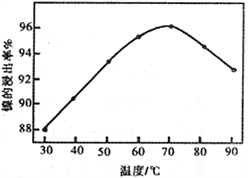
(2)右图表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是_____________________________。
(3)工艺流程中的“副产品”为________(填化学式)。
(4)已知有关氢氧化物开始沉淀和沉淀完全的pH 如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案是否正确进行判断并做出评价: ___________________________________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =________________。(常温时,Ksp(CaF2)=2.7×10-11)
=________________。(常温时,Ksp(CaF2)=2.7×10-11)
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;生产1mol ClO-,消耗OH-______________mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100 mL0.3mol/L和300 mL0.25mol/L的硫酸注入500 mL的容量瓶中,加水稀释至刻度线,则该混合液中H+的物质的量浓度为
A. 0.21mol/L B. 0.26mol/L C. 0.42mol/L D. 0.56mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO,主要反应为①C(s)+CO2(g)![]() 2CO(g)△H
2CO(g)△H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(1)△H=_____________。
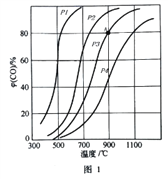
(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图像回答问题:
①若在温度为900℃,压强为P的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________,判断理由是_______________。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________。
(3)化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________(填序号)。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)2011年,内蒙古、新疆、浙江等地都要陆续召开各具特色的农博会,到时“生态农业”将成为农会人员关注的热门话题。生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是________。
(2)原混合气体中氮气的体积分数为________。
(二)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为___________________
(三)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
已知0.2 mol KBrO3在反应中得到1 mol电子生成X,请将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_________________
![]() +
+![]()
(四) 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)、过氧化钠为原料制取氧气,当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钠溶液中得到氯化钠固体,选择装置____(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置____;从碘水中提取I2,选择装置____,该分离方法的名称为________。
(2)装置A中①的名称是____________,冷却水的方向是______________,温度计水银球的位置是在_____________;装置B在分液时装置中的液体不能顺利滴下,原因是___________________________。
(3)从碘水中提取碘时,不能选用的试剂是______。
A.酒精 B.苯 C.四氯化碳
若选择试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后,下层液体的颜色为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
①该原子的相对原子质量为12a/b ②m g该原子的物质的量为 m/aNAmol
③该原子的摩尔质量是aNA g ④Wg该原子中含有W/a个该原子
⑤由已知信息可得:NA=12/a
A. ①②④ B. ①③ C. ②③ D. ③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com