
【题目】(1)取1.43g Na2CO3·10H2O溶于水配成100mL溶液,求:Na2CO3物质的量浓度________,取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积_________(设稀释时,对溶液体积的影响忽略不计)
(2)用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL0.5mol/L的稀H2SO4,所需浓H2SO4的体积为__________,如果实验室有10mL、20mL、50mL量筒,应选用___________mL量筒,定容时俯视刻度线测定结果会____________________(填偏高、偏低、无影响)
【答案】0.05mol/L 230mL 13.6mL 20 偏高
【解析】
(1)根据n=![]() 计算n(Na2CO3·10H2O),结合溶液体积计算c(Na2CO3);根据c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)计算V(稀溶液),进一步计算蒸馏水的体积。
计算n(Na2CO3·10H2O),结合溶液体积计算c(Na2CO3);根据c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)计算V(稀溶液),进一步计算蒸馏水的体积。
(2)根据稀释前后H2SO4物质的量不变列式计算所需浓硫酸的体积。根据“大而近”的原则选择量筒的规格。根据公式c=![]() 进行误差分析。
进行误差分析。
(1)n(Na2CO3·10H2O)=![]() =0.005mol,则溶质Na2CO3物质的量为0.005mol,c(Na2CO3)=
=0.005mol,则溶质Na2CO3物质的量为0.005mol,c(Na2CO3)=![]() =0.05mol/L;根据c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液),0.05mol/L×0.02L=0.004mol/LV(稀溶液),解得V(稀溶液)=0.25L,稀释时对溶液体积的影响忽略不计,则加入蒸馏水的体积为0.25L-0.02L=0.23L=230mL。
=0.05mol/L;根据c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液),0.05mol/L×0.02L=0.004mol/LV(稀溶液),解得V(稀溶液)=0.25L,稀释时对溶液体积的影响忽略不计,则加入蒸馏水的体积为0.25L-0.02L=0.23L=230mL。
(2)稀释前后H2SO4物质的量不变,则1.84g/cm3V(浓H2SO4)×98%÷98g/mol=0.5mol/L×0.5L,解得V(浓H2SO4)=13.6mL。根据“大而近”的原则,应选用20mL量筒。定容时俯视刻度线,会使所配溶液体积偏小,所配溶液浓度偏高。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
【题目】下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
A.10℃20mL 3mol/L的X溶液
B.20℃30mL 2molL的X溶液
C.20℃10mL 4mol/L的X溶液
D.10℃10mL 2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是()
A.Al2O3熔点高,可用作耐高温材料
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.SO2具有氧化性,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质(Li+可自由通过),用该电池为电源电解含镍酸性废水并得到单质Ni,实验装置如图所示。下列说法正确的是( )
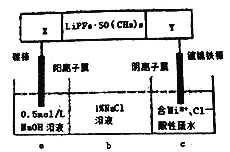
A. 电极X应为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO,主要反应为①C(s)+CO2(g)![]() 2CO(g)△H
2CO(g)△H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(1)△H=_____________。
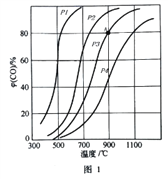
(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图像回答问题:
①若在温度为900℃,压强为P的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________,判断理由是_______________。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________。
(3)化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________(填序号)。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的无色水溶液只可能含有以下离子中的若干种:K+、NH4+、Fe2+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g.
综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________。
(2)该混合物中一定含有的离子__________;可能含有的离子__________。
(3)K+物质的量: n(K+)_____(具体值或取值范围)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,则所得混合气体的平均摩尔质量为_______。(保留一位小数)
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为____L。
Ⅱ. 标准状况下,用一定量的水吸收氨气后制得溶液浓度为17.0 mol·L-1,密度为0.90 g·mL-1的氨水,试计算1体积水吸收_______体积的氨气可制得上述氨水。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是 ( )
A. 过氧化氢的电子式:![]()
B. HClO的结构式为:H—Cl—O
C. 氟离子的结构示意图:![]()
D. MgO的形成过程可以表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正丁烷(CH3CH2CH2CH3)易发生两种裂解反应:
Ⅰ.CH3CH2CH2CH3 (g)![]() CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
(1)维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=________;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将________(填“增大”、“不变”或“减小”),原因为____________________________________________________。
(2)一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g)![]() CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
①△H3=________。
②5min内该反应的反应速率v(CH4)=________。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4,平衡后容器内CH4的体积分数为________。
(3)将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
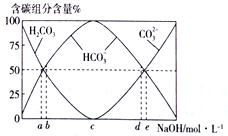
其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是________(选填“a”、“b”、“c”、“d”或“e” ),
(4)以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com