
【题目】Ⅰ.臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,则所得混合气体的平均摩尔质量为_______。(保留一位小数)
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为____L。
Ⅱ. 标准状况下,用一定量的水吸收氨气后制得溶液浓度为17.0 mol·L-1,密度为0.90 g·mL-1的氨水,试计算1体积水吸收_______体积的氨气可制得上述氨水。(保留整数)
【答案】35.6 g·mol-1 3 623
【解析】
Ⅰ.设原有O2为1mol,计算转化的氧气与生成的臭氧的物质的量,进而计算剩余的氧气的物质的量,依据平均摩尔质量等于气体的总质量与总物质的量之比计算;用差量法计算臭氧的体积。Ⅱ.结合c=1000ρw/M来计算氨水的质量分数,再依据质量分数计算1体积水吸收氨气的体积。
Ⅰ.(1)设原有1mol O2,发生反应的O2为1mol×30%=0.3mol,由化学方程式可得:
3O2![]() 2O3
2O3
3 2
0.3 0.2
即反应生成0.2mol臭氧,则混合气的平均摩尔质量为:(32×0.7+0.2×48)/(0.7+0.2) = 35.6 g/mol。(2)设8L氧气中xL转化为臭氧,由化学方程式可得:
3O2![]() 2O3
2O3
3 2
x 2x/3
即反应生成2x/3L臭氧(原状况),由反应得到气体6.5L得关系式:(8-x) + 2x/3 = 6.5,解得x = 4.5,则生成臭氧的体积为2×4.5/3 = 3L。
Ⅱ. 氨水的浓度为c=1000ρw/M=(1000×0.90g·mL×W%)/17g·mol=17.0mol/L,解得W%=32%;设氨气体积为VL,则水为1L,氨气的物质的量为V/22.4mol,氨气的质量为17V/22.4 g, 水的质量为1000mL×1g/mL=1000g,氨水溶液质量为(1000+17V/22.4)g,则由W%=![]() ×100%= 32%解得,V=623L。
×100%= 32%解得,V=623L。


科目:高中化学 来源: 题型:
【题目】下列关于浓HNO3与浓H2SO4的叙述正确的是( )
A.常温下遇铁都发生钝化B.常温下都能与铜反应产生氢气
C.露置于空气中,溶液质量均不变D.露置于空气中,溶液浓度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D 表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
![]()
A.Cl2+2OH-=Cl-+ClO-+H2O
B.Cu2++2OH-=Cu(OH)2↓
C.Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
D.OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取1.43g Na2CO3·10H2O溶于水配成100mL溶液,求:Na2CO3物质的量浓度________,取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积_________(设稀释时,对溶液体积的影响忽略不计)
(2)用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL0.5mol/L的稀H2SO4,所需浓H2SO4的体积为__________,如果实验室有10mL、20mL、50mL量筒,应选用___________mL量筒,定容时俯视刻度线测定结果会____________________(填偏高、偏低、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬(Cr)的本意是颜色,因为它的化合物或离子都有美丽的颜色。下表是几种常见含铬的离子水溶液的颜色:
离子 | Cr2O72- | Cr(OH)4 | Cr3+ | CrO42- | Cr2+ |
颜色 | 橙色 | 绿色 | 蓝紫色 | 黄色 | 蓝色 |
(1)铬铁矿的主要成分是Fe(CrO2)2,该物质中三种元素的化合价均为整数,则Cr的化合价是_____________。
(2)向Na2CrO4溶液中加入浓盐酸,溶液会变为蓝紫色并有黄绿色气体产生,则氧化剂和还原剂的物质的量之比为_____________。
(3)向Na2Cr2O7溶液中加入浓NaOH溶液,会变成黄色,请解释原因(用离子方程式和必要的文字说明)_____________________________________________。
(4)工业上以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料,生产重铬酸钠晶体(Na2Cr2O7·2H2O)。主要工艺流程如下:
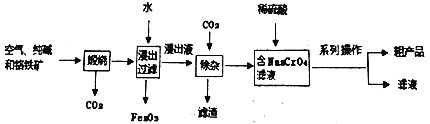
①滤渣的成分是_____________(写化学式)
②写出煅烧过程中,所发生的非氧化还原反应的化学方程式(任写一个)______________________。
③煅烧过程中,所发生的氧化还原反应如下:(其中浸出液显黄色),请完成下面化学方程式并配平。
□Fe(CrO2)2+□Na2CO3+□O2=□_________+□Fe2O3+□CO2
④工业上在重铬酸钠溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据各地报纸报导,在一些建筑工地的食堂里,常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐对人有致癌作用。这种盐的化学式是:
A. MgCl2 B. NaCl C. NaNO2 D. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com