
����Ŀ����ͼΪԪ�����ڱ���һ���֣�

��1��Ԫ�آ۵Ļ�̬ԭ�ӹ����ʾʽΪ_________________��
��2��Ԫ�آ�ԭ�ӵ���Χ�����Ų�ʽΪ__________��
��3��Ԫ�آۢܢݵĵ�һ�������ɴ�С��˳��Ϊ___________����Ԫ�ط��ţ���������Ӱ뾶�ɴ�С��˳��Ϊ______________�������ӷ��ţ���
��4���������̬�⻯���зе�ϸߵ���_______���ѧʽ����ԭ����______________��
��5��������ϵ�ԭ�Ӽ䷴Ӧ�������γ����Ӽ�����_____��ѡ��A��B��C��D����ͬ�����������γɹ��ۼ�����_____���õ���ʽ��ʾ�ù��ۻ�������γɹ���______________��
A���͢� B���͢�
C���ݺ͢� D���͢�
��6��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�آڵĵ��ʼ��仯���������Ƶ����ʣ�д��Ԫ�آڵ������������NaOH��Һ��Ӧ�����ӷ���ʽ_________________________________________________��
��7��������������Ԫ�صĵ�һ�����ĵ��������ݣ���λ��KJ��mol��1�����ش�������⣺
Ԫ�ش��� | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
�������ڱ��У�����ܴ���ͬһ�������_________����Ԫ�ش��ţ���
����TΪ��������Ԫ�أ���T����________���s������p������d������ds������Ԫ�أ�Z�ǵ�������Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���T��Z�γɵĻ���������__������ۡ������ӡ��������
���𰸡� ![]() 3d64s2 F��N��O N3����O2����F- HF HF���γɷ��Ӽ���� C B
3d64s2 F��N��O N3����O2����F- HF HF���γɷ��Ӽ���� C B ![]() 2OH��+BeO=BeO22��+H2O R ��U p ����
2OH��+BeO=BeO22��+H2O R ��U p ����
��������(1). ��ΪNԪ����N��7��Ԫ������̬ԭ�ӵ����Ų�ʽΪ��1s22s22p3�����̬ԭ�ӹ����ʾʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2). ��ΪFeԪ�أ�Fe��26��Ԫ�أ�ԭ�ӵ���Χ�����Ų�ʽΪ��3d64s2���ʴ�Ϊ��3d64s2��
(3). Ԫ�آۢܢݷֱ�ΪN��O��F��ͬһ���ڴ������ң���һ�����ܳ��������ƣ�������Ԫ����FԪ�صĵ�һ���������NԪ�صĻ�̬ԭ�ӵ����Ų�ʽΪ��1s22s22p3����һ�ְ�������ȶ��ṹ����һ������N��O������N��O��F����Ԫ�صĵ�һ�������ɴ�С��˳��ΪF��N��O��N��O��F����Ԫ�صļ����Ӿ�����ͬ�ĵ��Ӳ�ṹ��ԭ������Խ�����Ӱ뾶ԽС������N��O��F����Ԫ�صļ����Ӱ뾶�ɴ�С��˳��Ϊ��N3����O2����F�����ʴ�Ϊ��F��N��O��N3����O2����F����
(4). ��HF����֮��������������HF�ķе����HCl���ʴ�Ϊ��HF��HF���γɷ��Ӽ������
(5). �ɸ����������ڱ��е�λ�ÿ�֪����ΪH����ΪBe����ΪF����ΪNa����ΪCl������Ԫ��������õĽ����ƺ�����õķǽ�����֮���������γ����Ӽ�����ΪC��ǽ���Ԫ��֮���������γɹ��ۼ�����ΪB��û�����ΪHF��H��Fԭ��֮���γ�һ�����õ��Ӷԣ��õ���ʽ��ʾHF�γɹ��̵�ʽ��Ϊ��![]() ���ʴ�Ϊ��C��B��
���ʴ�Ϊ��C��B��![]() ��
��
(6). Be��AlԪ�صĵ��ʼ��仯����������Ƶ����ʣ���BeOҲ�������ԣ�BeO��NaOH��Һ��Ӧ����Na2BeO2��ˮ���÷�Ӧ�����ӷ���ʽΪ��2OH��+BeO=BeO22��+H2O���ʴ�Ϊ��2OH��+BeO=BeO22��+H2O��
(7).��Ԫ�صĵ����ܿ��Կ�����Q�ĵ����ܴܺ���Ϊ����Ԫ�أ�R��U�ĵ�һ�����ܽ�С���ڶ������ܾ������ʱ���+1�ۣ�����������Ϊ1������λ��ͬһ���壬E�ĵ�һ���ڶ������ܽ�С�����������ܾ������ʱ���+2�ۣ�����������Ϊ2��T�ĵ�һ���ڶ������������ܽ�С�����ĵ����ܾ���������+3�ۣ�����������Ϊ3��
��. R��U�ĵ�һ�����ĵ����ܱ仯�������ƣ���R��U�������ͬһ���壬�ʴ�Ϊ��R��U��
��. ������������֪��T�ĵ�һ���ڶ������������ܽ�С�����ĵ����ܾ���������+3�ۣ�����������Ϊ3����TΪ��������Ԫ�أ���TΪAlԪ�أ�AlԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ��1s22s22p63s23p1������p��Ԫ�أ�Z�ǵ�������Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���Z��ClԪ�أ�Al��ClԪ��֮��縺������С���Թ��ۼ������γ�AlCl3������AlCl3�ǹ��ۻ�����ʴ�Ϊ��p�����ۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ�����С��������һ�ִӷϾɵĺ�������(��Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO�ȣ����������¹��ա�������������ͼ��
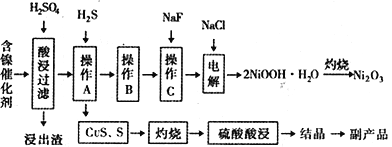
�ش�����������
��1����������Ҫ�ɷ�ΪCaSO4����2H2O��_______________�������ʡ�
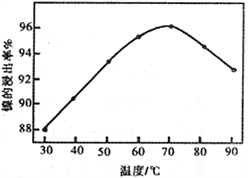
��2����ͼ��ʾ���Ľ��������¶ȵĹ�ϵ���������¶ȸ���70��ʱ�����Ľ����ʽ�������������Ni(OH)2����������ԭ����_____________________________��
��3�����������еġ�����Ʒ��Ϊ________���ѧʽ����
��4����֪�й��������↑ʼ�����ͳ�����ȫ��pH ���±���
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.7 | 9.7 | 9.2 |
����B��Ϊ�˳�ȥ��Һ�е���Ԫ�أ�ijͬѧ���������ʵ�鷽���������A���õ���Һ�м���NaOH��Һ��������ҺpHΪ3.7��7.7�����ã����ˡ���Ը�ʵ�鷽���Ƿ���ȷ�����жϲ����������� ___________________________________����ԭ������ȷ����˵�����ɣ���ԭ������������Ը�������
��5������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10-3mol��L-1������Һ��![]() =________________��������ʱ��Ksp(CaF2)=2.7��10-11��
=________________��������ʱ��Ksp(CaF2)=2.7��10-11��
��6��������2NiOOH��H2O��ԭ����������
�ټ���������Cl-������������ΪClO-������1mol ClO-������OH-______________mol��
��Ni2+��ClO-��������2NiOOH��H2O��������ò���Ӧ�����ӷ���ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��2011�꣬���ɹš��½����㽭�ȵض�Ҫ½���ٿ�������ɫ��ũ���ᣬ��ʱ����̬ũҵ������Ϊũ����Ա��ע�����Ż��⡣��̬ũҵ�漰ũ�ҷ��ϵ��ۺ����ã�ij�ַ��Ͼ����͵õ�һ�ֺ����顢������̼�������Ļ�����塣2.016 L(��״��)������ͨ��ʢ�к���CuO��ĩ��Ӳ�ʲ����ܣ������ķ�ӦΪ��CH4��4CuO![]() CO2��2H2O��4Cu����������ȫ��Ӧ��Ӳ�ʲ����ܵ���������4.8 g������Ӧ�����������ͨ������ij���ʯ��ˮ�У�������գ����ɳ���8.5 g��
CO2��2H2O��4Cu����������ȫ��Ӧ��Ӳ�ʲ����ܵ���������4.8 g������Ӧ�����������ͨ������ij���ʯ��ˮ�У�������գ����ɳ���8.5 g��
��1��ԭ��������м�������ʵ�����________��
��2��ԭ��������е������������Ϊ________��
������FeS��һ��Ũ�ȵ�HNO3��Ӧ������Fe(NO3)3��Fe2(SO4)3��NO2��N2O4��NO��H2O����NO2��N2O4����NO�����ʵ���֮��Ϊ1�s1�s1ʱ��ʵ�ʲμӷ�Ӧ��FeS��HNO3�����ʵ���֮��Ϊ___________________
������ij��Ӧ�з�Ӧ�����������У�AsH3��H2SO4��KBrO3��K2SO4��H3AsO4��H2O��һ��δ֪����X��
��֪0.2 mol KBrO3�ڷ�Ӧ�еõ�1 mol��������X���뽫�������ͻ�ԭ���Ļ�ѧʽ������ƽ���ϵ���������з����У����������ת�Ƶķ������Ŀ��_________________
![]() ��
��![]()
���ģ� ��һ�������£��ֱ��Ը�����ء�����ء���������(H2O2)����������Ϊԭ����ȡ���������Ƶ�ͬ�¡�ͬѹ����ͬ�����O2ʱ���ĸ���Ӧ��ת�Ƶĵ�����֮��Ϊ_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺

��1�����Ȼ�����Һ�еõ��Ȼ��ƹ��壬ѡ��װ��____�������װ��ͼ����ĸ����ͬ������ȥ����ˮ�е�Cl�������ʣ�ѡ��װ��____���ӵ�ˮ����ȡI2��ѡ��װ��____���÷��뷽��������Ϊ________��
��2��װ��A�Тٵ�������____________����ȴˮ�ķ�����______________,�¶ȼ�ˮ�����λ������_____________��װ��B�ڷ�Һʱװ���е�Һ�岻��˳�����£�ԭ����___________________________��
��3���ӵ�ˮ����ȡ��ʱ������ѡ�õ��Լ���______��
A.�ƾ�������������B.������������C.���Ȼ�̼
��ѡ���Լ�X���ܶ�С��ˮ���ܶȣ��ӵ�ˮ����ȡ��ʱ����������ú��²�Һ�����ɫΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⡣
AԪ�صĺ���������͵��Ӳ�����ȣ�Ҳ����������ḻ��Ԫ�� |
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��� I1��738 kJ/mol��I2��1 451 kJ/mol��I3��7 733 kJ/mol��I4��10 540 kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص������������������IJ�Ϊ4 |
F��ǰ�������е縺����С��Ԫ�� |
G�����ڱ��ĵ����� |
��1����֪BA5Ϊ���ӻ����д�������ʽ______________________________��
��2��B��̬ԭ����������ߵĵ��ӣ���������ڿռ���________������ԭ�ӹ����________�Ρ�
��3��ijͬѧ����������Ϣ���ƶ�C��̬ԭ�ӵĺ�������Ų�Ϊ![]() ��ͬѧ�����ĵ����Ų�ͼΥ����_____________________________________��
��ͬѧ�����ĵ����Ų�ͼΥ����_____________________________________��
��4��Gλ��________��________�����۵����Ų�ʽΪ________��
��5������FԪ�صķ�����________������ԭ�ӽṹ��֪ʶ���Ͳ����������ԭ����_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɫ��ĩ����DZˮͧ����Ϊ��������Դ������������������������ͼ��ʾת����ϵ��������գ�
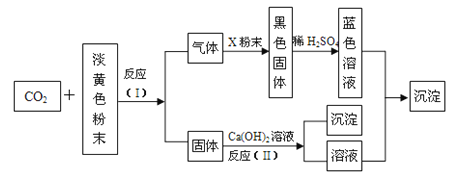
��1���õ���ɫ��ĩΪ__________________��
��2��X��ĩ�����ƻ�ѧʽΪ__________________��
��3����Ӧ��I���Ļ�ѧ����ʽΪ______________________________��
��4����Ӧ��II���Ļ�ѧ����ʽΪ_____________________________��
��5����Ӧ���Ļ�ѧ����ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Ҹոշ�����ij��Ԫ�ص�ԭ�ӣ�1����ԭ��������a g��һ��12Cԭ��������b g��NA�ǰ����ӵ�������ֵ������˵����ȷ����
����ԭ�ӵ����ԭ������Ϊ12a/b ��m g��ԭ�ӵ����ʵ���Ϊ m/aNAmol
����ԭ�ӵ�Ħ��������aNA g ��Wg��ԭ���к���W/a����ԭ��
������֪��Ϣ�ɵã�NA=12/a
A. �٢ڢ� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���Na2CO3�������к���NaCl���ʣ�Ϊ�ⶨ�����д��������������������ͼ�е�װ�ý���ʵ�顣
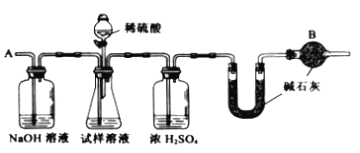
��Ҫʵ�鲽�����£�
����ͼ��װ�����������װ�õ������ԣ�
����a g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ��
������ʢ�м�ʯ�ң�CaO��NaOH���������U�ܵ��������Ƶ�Ϊb g��
���ӷ�Һ©������6 mol��L-1 �����ᣬֱ�����ٲ�������ʱΪֹ��
���ӵ���A����������һ�����Ŀ�����
���ٴγ���ʢ�м�ʯ�ҵ�U�ܵ�������
���ظ������������IJ�����ֱ��U�ܵ������������䣬���ճƵ�Ϊc g��
����պͻش����⣺
��1��װ���и����B��������__________________________________________
��2����������Ŀ����__________________________________________________
��3����������Ŀ����__________________________________________________
��4���������д�������������ļ���ʽΪ___________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com