
【题目】某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中-lgc(M)(M为Cl-或CrO42-)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确的是( )

A.曲线L1表示-lgc(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼、电镀、电路板生产等过程会产生大量的 Cu2+,Cu2+是一种重金属离子,严重影响水生动植物的生长发育,对人体健康也有很大危害,必须经过处理达标后方可排放。某电路板生产企业的水质情况及国家允许排放的污水标准如下表:
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+(mg/L) | 1470 | ≤0.5 |
氨氮(mg/L) | 2632 | ≤15 |
Ⅰ.为研究上述废水中 Cu2+的处理方法并实现 Cu 的资源化回收,有研究者进行了如下实验: 向一定体积的废水中加入一定量废铁屑和焦炭粉,置于搅拌器上搅拌 90min、静置,经分析测得上清液中铜含量约为 72mg/L;滤出上清液,向滤液中加入一定量 FeS 固体,充分搅拌后静置,经分析测得其中铜含量已经达标。
(1)在 pH=1.0 的废水中,氨氮的主要存在形式是_____(用化学式表示)。
(2)①加入废铁屑后,废水中的铜含量明显减少,反应的离子方程式是_____
②加入焦炭可以加快反应速率,原因是_________________________________
(3)结合化学用语解释加入 FeS 固体使废水达标的原因_________________________。
(4)在处理废水过程中使用的铁粉会因表面布满一层铜膜而失效,因此要对失效的铁粉进行活化处理,同时回收铜。处理方法为:用一定浓度的氨水浸泡包覆铜膜的铁粉,露置在空气中一段时间后,可以将表面的 Cu 转化为[Cu(NH3)4]2+与铁粉分离。
请写出 Cu 转化为 [Cu(NH3)4]2+的离子方程式:_____。
Ⅱ为研究废水处理的最佳 pH,取五份等量的 I 中上清液, 分别用 30%的 NaOH 溶液调节 pH 值至 8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量。实验结果如图所示。查阅资料可知:Cu(OH)2 + 4NH3![]() [Cu(NH3)4]2+ + 2OH-。
[Cu(NH3)4]2+ + 2OH-。
(5)根据实验结果,你认为最佳的 pH 约为_____________________________。结合资料解释实验结果呈图中 b~d 段曲线所示的原因:_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
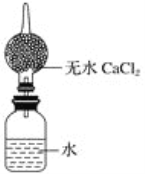
①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不相同,分别如(I)和(Ⅱ)所示,
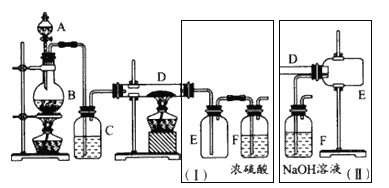
试回答:
(1)B中反应的化学方程式为___________________________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是______________。
(3)D中反应的化学方程式为______________________________。
(4)装置(I)的主要缺点是_______________________。
(5)装置(Ⅱ)的主要缺点是______________________________,如果选用此装置来完成实验,则必须采取的改进措施是:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A+3B![]() 2C+D,(A、B、C、D都为气体)在四种不同条件下的反应速率分别如下,则该反应在不同条件下反应速率最快的是( )
2C+D,(A、B、C、D都为气体)在四种不同条件下的反应速率分别如下,则该反应在不同条件下反应速率最快的是( )
A.v(A)=0.5mol/ (L·min)B.v(B)=0.6mol/ (L·min)
C.v(C)=0.35mol/ (L·min)D.v(D)=0.4mol/ (L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“新冠病毒”疫情让人们再次认识到化学的重要性。下列有关抗疫物资的化学用语表示正确的是( )
A.中子数为127的碘原子:![]()
B.供氧剂中过氧化钙(CaO2)的电子式:![]()
C.84消毒液中次氯酸钠的电离方程式:NaClO![]() Na++ClO-
Na++ClO-
D.口罩“熔喷层”原料中聚丙烯的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁的一个反应如下: CO(g)+FeO(s)![]() CO2(g)+Fe(s),△H>0已知1100℃时K=0.263
CO2(g)+Fe(s),△H>0已知1100℃时K=0.263
(1)其平衡常数的表达式为K=___。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值___(填“增大”“减小”或“不变”下同),平衡常数K的变化是___。如果温度不变,在原平衡体系中继续加入一定量CO,达新平衡时,CO的体积分数和原平衡相比___。
(2)1100℃时,若测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应___(填“已经”或“没有”)处于化学平衡状态,此时化学反应速率是v(正)___(填“大于”“小于”或“等于”)v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com