
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
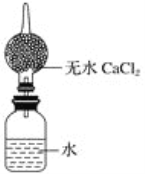
①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
【答案】B 氧气 水蒸气 煤油 D b/(a+b-c) 吸收H2中所含的H2O(g)
【解析】
(1)根据钠的性质分析解答;
(2)钠的性质很活泼,易和水、氧气反应,据此解答;
(3)金属钠投入水中生成氢氧化钠和氢气,根据溶液中的溶质分析解答;
(4)①根据钠与水反应产生氢气的质量关系以及反应前后质量差解答;
②根据产生的气体中含有水蒸气分析判断。
(1)A、钠是银白色金属,硬度很小,可以用小刀切,故A错误;
B、钠在空气中燃烧产物是淡黄色的过氧化钠,故B正确;
C、钠在空气中燃烧产物是淡黄色的过氧化钠,不是氧化钠,故C错误;
D、金属钠的熔点很低,故D错误;
故答案选B;
(2)钠性质很活泼,易和水、氧气反应,所以保存钠时要隔绝空气和水,钠和煤油不反应,且密度大于煤油,所以保存钠可以放在煤油中;
(3)A.钠和稀硫酸反应生成硫酸钠和氢气,没有沉淀产生,A不选;
B.钠投入硫酸铜溶液中,首先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,但沉淀不是白色的,而是蓝色的,B不选;
C.钠投入氢氧化钠溶液中生成氢氧化钠和氢气,没有沉淀,C不选;
D.钠投入氯化镁溶液中生成氯化钠、氢氧化镁白色沉淀和氢气,D选。
答案选D。
(4)①金属与水发生反应放出氢气的质量=ag+bg-cg=(a+b-c)g,假设金属为R,其相对原子质量为M,根据金属钠与水反应放出氢气的关系,可推断该金属与水放出氢气关系如下:
2R~~~~~H2
2M 2
bg (a+b-c)g
解得M=b/(a+b-c);
②氯化钙具有吸水能力,是常用的干燥剂,在装置中吸收生成氢气中的水,而防止水分流失。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】自来水常用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是 ( )
A. AgNO3 B. FeCl2
C. NaHSO3 D. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸钴[Co(H2PO2)2·6H2O]可用于化学电镀,共饱和溶液的pH约为6;利用电渗析法可在产品室析出高纯[Co(H2PO2)2·6H2O]电渗析原理如图所示。则阳离子交换膜有
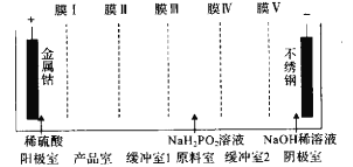
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z组成的二元化合物的水溶液pH=7。下列说法错误的是
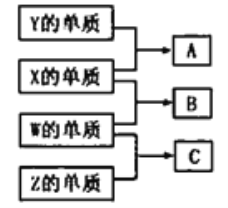
A. A与B的反应一定是化合反应
B. 离子半径:Z>X>Y>W
C. W、Y、Z均存在两种或两种以上的氧化物
D. 将等物质的量的A、C溶于同一烧杯水中,所得溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若某原子在处于能最最低状态时,外围电子排布为4d15s2,则下列说法正确的是___(填标号)
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是_______(填标号)
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为____(填标号)
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。
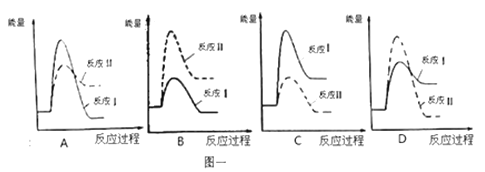
(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。
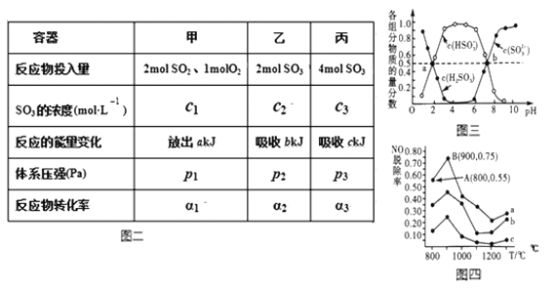
(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO![]() )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥及单线桥表示反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 电子转移情况。
双线桥________________________________________。
单线桥________________________________________。
该反应中氧化剂是:_______。若有4molHNO3参加反应,转移电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类化合物在维生素C的作用下能够转化为有毒的+3价的含砷化合物。通过以上信息填空:上述过程中+5价砷类物质作为______(填氧化剂或还原剂),+5价砷元素发生______反应(填氧化或还原);0.5mol+5价砷完全转化为+3价砷,共转移______个电子。
(2)实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
①用双线桥标出电子转移方向和数目______;(在答题纸上标)
②在标准状况下生成的氯气为11.2L时,被氧化的HCl的质量为______;
③为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,写出反应的离子方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com