
【题目】次磷酸钴[Co(H2PO2)2·6H2O]可用于化学电镀,共饱和溶液的pH约为6;利用电渗析法可在产品室析出高纯[Co(H2PO2)2·6H2O]电渗析原理如图所示。则阳离子交换膜有
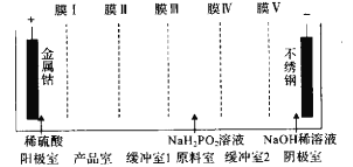
A. 1个 B. 2个 C. 3个 D. 4个
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为了测定某铜银合金的组成,将30.0g合金溶于80.0mL 13.5mol·L1的浓HNO3中。待合金完全溶解后,收集到气体6.72L(标准状况下)并测得H+浓度为1mol·L1。假设反应后溶液的体积为80.0mL,试计算:
(1)被还原的硝酸的物质的量___________;
(2)合金中银的质量分数___________。
(3)确定6.72L气体中各成分的物质的量___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃熔点-116℃。实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):

回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2。请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注。_______
(2)B中试剂a应选用______(填下列序号字母)。
a.CCl4 b.饱和NaCl溶液 c.浓H2SO4 d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成棕黄色的物质Cl2O,该物质常温下为气体,方程式为:________
Cl2+ Na2CO3+ == NaHCO3+ NaCl+ Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置。
实验步骤 | 现象和结论 |
步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 | |
步骤二:向a试管中滴加BaCl2溶液,静置。 | 无明显现象,证明固体中不含Na2CO3 |
步骤三:_______________ | _______________ |
步骤四:_______________ | _______________ 则证明固体中含有NaCl。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙分别是甲烷、苯中的一种,已知:乙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色;甲既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应,且一定条件下,1 mol甲可以和3 mol H2完全加成。
(1)甲的结构简式:___________,乙的空间结构:______________________;
(2)写出乙与Cl2反应生成一氯代物的化学方程式:__________________________________________;
(3)把甲加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_________(填“上”或“下”)层;
(4)在浓硫酸作用下,甲与浓硝酸反应的化学方程式:_________________________________________;
(5)等物质的量的甲、乙完全燃烧消耗O2的物质的量________________(填“甲>乙”、“甲<乙”或“甲=乙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
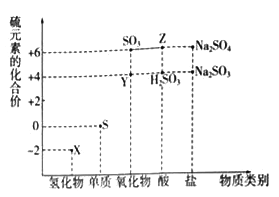
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电极上每通过96500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是
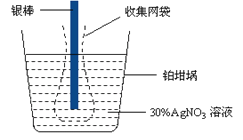
A. 若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
B. 称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96.5 C
C. 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D. 电量计中的银棒应与电源的正极相连,铂坩埚上生的电极反应是:Ag+ + e- = Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
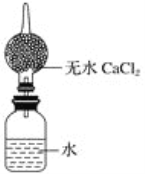
①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com