
| A. | 氢气还原氧化镁 | B. | 加热碳酸钙 | C. | CO还原氧化铁 | D. | 电解饱和食盐水 |
分析 金属的冶炼方法有电解法、热还原法、热分解法等,电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得,据此解答.
解答 解:A.镁的还原性强于氢气,不能通过氢气还原氧化镁制取镁,应采用电解熔融氯化镁的方法制取镁,故A错误;
B.加热碳酸钙生成氧化钙和二氧化碳,得不到钙,钙性质活泼,应采用电解熔融氯化钙的方法制取钙,故B错误;
C.铁性质较活泼,用还原法即可制取铁,故C正确;
D.电解饱和食盐水生成氢氧化钠、氢气和氯气,得不到钠,钠性质活泼,应采用电解熔融氯化钠的方法制取钠,故D错误;
故选:C.
点评 本题考查了金属的冶炼,根据金属的活泼性采用相应的冶炼方法,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
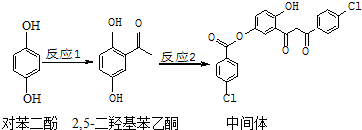
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠中阴离子数目为2NA | |
| B. | 1mol氯气与足量的NaOH溶液反应,转移电子的数目为2 NA | |
| C. | 标准状况下,11.2L氨水含有0.5 NA个NH3分子 | |
| D. | 9g水中含有5 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
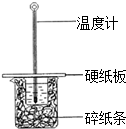 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| B. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| C. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com