
| A. | 1mol过氧化钠中阴离子数目为2NA | |
| B. | 1mol氯气与足量的NaOH溶液反应,转移电子的数目为2 NA | |
| C. | 标准状况下,11.2L氨水含有0.5 NA个NH3分子 | |
| D. | 9g水中含有5 NA个电子 |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、氯气和氢氧化钠的反应为歧化反应;
C、标况下,氨水为液态;
D、求出水的物质的量,然后根据1mol水中含10mol电子来分析.
解答 解:A、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含1mol阴离子即NA个,故A错误;
B、氯气和氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子即NA个,故B错误;
C、标况下,氨水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、9g水的物质的量为0.5mol,而1mol水中含10mol电子,故0.5mol水中含5mol电子即5NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成的难易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 | H2、Br2混合,加热时发生化合 | H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
| A. | 同周期元素的金属性随原子序数递增而增强 | |
| B. | 同周期元素的非金属性随原子序数递增而增强 | |
| C. | 第VIIA族元素的非金属性随电子层数的增加而减弱 | |
| D. | 第VIIA族元素的金属性随电子层数增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
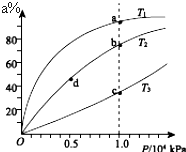 现有反应:mA+nB?ρC,在某温度下达到平衡状态.
现有反应:mA+nB?ρC,在某温度下达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| B. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| C. | 向0.1mol/L CH3COOH溶液中加入少量的冰醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$的值变小 | |
| D. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| B. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com