
【题目】与H2完全加成后,不可能生成2,2,3-三甲基戊烷的烃是( )
A. 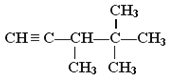 B.
B. 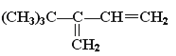
C. CH2=CHC(CH3)2CH(CH3)2D. (CH3)3CC(CH3)=CHCH3
科目:高中化学 来源: 题型:
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1。由图中可以看出,该同学在操作时的一个错误是___,烧杯的实际质量为____g。
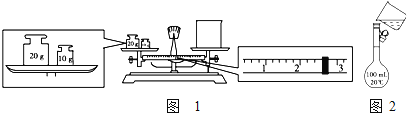
(2)需配制250mL0.2molL-1氯化钠溶液,图2是该同学转移溶液的示意图。指出上面图2中存在的两个错误:①____②____。
(3)用质量分数为98%密度为1.84gcm-3的浓硫酸配制1000mL0.1mol·L-1稀硫酸。
①应用量筒量取浓硫酸____mL。
②配制硫酸溶液时需要用到的仪器有___、____、___、___(除量筒外,写出其余四种)。
③下列操作结果,使所配制溶液物质的量浓度偏高的是____。
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.定容时俯视刻度线
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0 ℃~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:
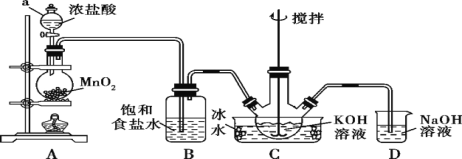
回答下列问题:
(1)制备KClO。
①仪器a的名称是________________;装置B吸收的气体是________。
②装置C中三颈烧瓶置于冰水浴中的目的是______________;装置D的作用是_____________。
(2)制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为________________________________。
②向装置C中加入饱和________溶液,析出紫黑色晶体,过滤。
(3)测定K2FeO4纯度。测定K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
a.FeO42-+CrO2-+2H2O═CrO42-+Fe(OH)3↓+OH-
b.2CrO42-+2H+═Cr2O72-+H2O
c.Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
称取2.0g制备的K2FeO4样品溶于适量KOH溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250mL容量瓶中定容.取25.00mL加入稀硫酸酸化,用0.10 molL-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00mL,则该K2FeO4样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)800℃时,某密闭容器中存在如下反应:2NO2(g) ![]() 2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
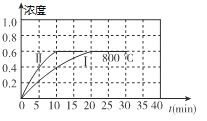
①反应Ⅱ相对于反应I而言,改变的条件可能是_______________.
②800℃时,若开始时向容器中同时加入1mol/LNO、0.2mol/LO2、0.5mol/L NO2,则v正____________v逆(填“<”、“>”或“=”)
(2)己知N2O4(g) ![]() 2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
①c(X)代表__________(填化学式)的浓度,该反应的平衡常数K=_____________。
②前10min内用NO2浓度变化表示的反应速率为___________,20min时改变的条件是_____________;重新达到平衡时,NO2的质量分数___________________。
a.增大 b.减小
c.不变 d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过蒸馏石油得到多种沸点范围不同的馏分,装置如图所示。下列说法不正确的是
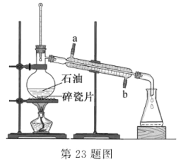
A.沸点较低的汽油比沸点较高的柴油先馏出
B.蒸馏烧瓶中放人沸石可防止蒸馏时发生暴沸
C.冷凝管中的冷凝水应该从 a 口进 b 口出
D.温度计水银球的上限和蒸馏烧瓶支管口下沿相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
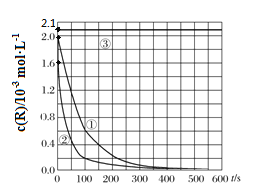
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A+2BC+3D 各物质均为气体在不同情况下测得有下列 4 种反应速率, 其中反应最快的是
A.v(A)=0.45mol·(L·s)![]() B.v(B)=0.6mol·(L·s)
B.v(B)=0.6mol·(L·s)![]()
C.v(C)=0.5mol·(L·s)![]() D.v(D)=0.4mol·(L·s)
D.v(D)=0.4mol·(L·s)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应:C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
A. 加入NaOH溶液,可增大乙醇的物质的量
B. 增大氢溴酸的浓度,有利于生成C2H5Br
C. 若反应物均增大至2 mol,则两种反应物平衡转化率之比变大
D. 若起始温度提高至60℃,有利于提高C2H5Br的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com