
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M������6������ |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | Ԫ����������ǣ�7�� |
W | �䵥�ʼ��ܸ��ᷴӦ�����ܸ�ǿ�Ӧ��������H2 |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ�����_____��
��2��Ԫ��Y����Ԫ���γ�һ������YH4����д��ij��Һ�к������ĵ���ʽ_____����μ��������_____��
��3��Ԫ��Z�����ڱ��е�λ��_____��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ����_____����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ����_____������ţ���
a.������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b.Z���⻯���T���⻯���ȶ�
c.һ�������£�Z��T�ĵ��ʶ���������������Һ��Ӧ
��4��̽Ѱ�������ʵIJ�������ѧϰ��ѧ����Ҫ����֮һ��T��X��Y��Z����Ԫ�ص�����������ˮ�����л�ѧ�������Բ�ͬ���������ֵ���_____��������_________��Z������������ˮ������W������������ˮ���ﷴӦ�����ӷ���ʽΪ_____________��
���𰸡�![]()
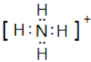 ȡ�����������뵽�Թ��У����� ŨNaOH��Һ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų������壬��ֽ��Ϊ��ɫ��˵�������д���NH4+ �������ڢ�A�� Cl b H2CO3 ֻ��H2CO3Ϊ���ᣬ����Ϊǿ�� 3H++Al(OH)3=Al3++3H2O
ȡ�����������뵽�Թ��У����� ŨNaOH��Һ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų������壬��ֽ��Ϊ��ɫ��˵�������д���NH4+ �������ڢ�A�� Cl b H2CO3 ֻ��H2CO3Ϊ���ᣬ����Ϊǿ�� 3H++Al(OH)3=Al3++3H2O
��������
�������Ԫ�����ʻ�ԭ�ӽṹ��֪��
T�ĺ��������Ϊ16��ΪSԪ�أ�X�����������Ǵ�����������2������XΪ�ڶ�����Ԫ�أ�ΪCԪ�أ������µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��Կ�֪����ΪN2���⻯���ˮ��Һ��NH3��H2O����YΪNԪ�أ�Ԫ��������۵���������������ZΪ�ڢ�AԪ�أ�FԪ�������ۣ���ZΪClԪ�أ����ʼ��ܸ��ᷴӦ�����ܸ�ǿ�Ӧ��������H2���õ���Ϊ����Al����WΪAlԪ�ء��ݴ˽��з����жϡ�
��1��![]() �ڿ��Ź��������ڲⶨһЩ������������Ϊ��
�ڿ��Ź��������ڲⶨһЩ������������Ϊ��![]() ��
��
��2��Ԫ��Y����Ԫ���γ�һ������YH4����NH4+�������ʽΪ��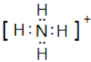 ����������ӵķ���Ϊ��ȡ�����������뵽�Թ��У�����ŨNaOH��Һ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų������壬��ֽ������˵�������д���NH4+����Ϊ��
����������ӵķ���Ϊ��ȡ�����������뵽�Թ��У�����ŨNaOH��Һ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų������壬��ֽ������˵�������д���NH4+����Ϊ��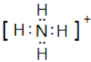 ��ȡ�����������뵽�Թ��У�����ŨNaOH��Һ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų������壬��ֽ������˵�������д���NH4+��
��ȡ�����������뵽�Թ��У�����ŨNaOH��Һ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų������壬��ֽ������˵�������д���NH4+��
��3��ZΪClԪ�أ������ڱ���λ�ڵ������ڡ��ڢ�A�塣ͬһ���ڴ������ң�Ԫ�صķǽ���������ǿ����ClԪ����SԪ����ȣ��ǽ����Խ�ǿ����ClԪ�ء��ɸ���Ԫ����������ѡ���ж���֤����һ��ʵ��ѡ�
a�����ʵ�״̬����ӦԪ�صķǽ�����ǿ��֮�䲻���ڱ�Ȼ��ϵ��a�����
b����ӦԪ�صķǽ����Ծ�Խǿ�����ɵ��⻯����ȶ���Խǿ���ʿ���֤��ClԪ�صķǽ����ԱȽ�ǿ��b����ȷ��
c����������NaOH��Һ��Ӧ����ӦԪ�صķǽ�����ǿ��û�б�Ȼ��ϵ��c�����
��ѡb��
�ʴ�Ϊ���������ڢ�A�壻Cl��b��
��4��T��X��Y��Z����Ԫ�ص�����������ˮ����ֱ��ǣ�H2SO4��H2CO3��HNO3��HClO4������H2CO3���ʲ�ͬ���������֣���Ϊֻ��H2CO3Ϊ���ᣬ����Ϊǿ�ᡣW������������ˮ����ΪAl(OH)3����HClO4��Ӧ�����ӷ���ʽΪ��3H++Al(OH)3=Al3++3H2O����Ϊ��H2CO3��ֻ��H2CO3Ϊ���ᣬ����Ϊǿ�3H++Al(OH)3=Al3++3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
A. ����ˮ���ռ�ͭ����Ũ���ᷴӦ������NO2
B. �ð�ˮ����NaCl��MgCl2��AlCl3��NH4Cl������Һ
C. ������KMnO4��Һ��֤����Ļ�ԭ��
D. �ñ���NaHCO3��Һ��ȥCl2�л��е�HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A g��״̼��Ƹ��������ᷴӦ����Ӧ����ʧ��������ʱ��ı仯��������ͼ��ʵ����ʾ������ͬ�������£���A g��ĩ״̼�����ͬŨ�����ᷴӦ������Ӧ�����ߣ�ͼ��������ʾ����ȷ����
A. B.
B.
C. D.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��10��1�����л���������70���꣬�����ڼ�Դ��������ʻ�ʩ����S-�տ����Ƽ��Ա�֤�ʻ�ʢ����������ͼ��ʾ���л���X������S���տ���Y.����˵������ȷ����( )

A.1mol Y��1mol Br2��Ӧ�IJ�����4��
B.1mol Y������NaOH��Һ��Ӧ,�������3mol NaOH
C.1mol X����ܼӳ�7mol H2
D.X���Է���������ȡ�����������Ӿۡ����۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�����ʴ�������˵������ȷ����

A.ͼ���������ڸ�������е�������������
B.ͼ�������Ͽ���Դ����բ�Ž��������ⸯʴ
C.ͼ����������բ�����Դ�ĸ����������ɷ�ֹ��բ�Ÿ�ʴ
D.ͼ����������M �� Fe ���ã��ɷ�ֹ��ˮ�ܸ�ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1������Fe��2HCl===FeCl2��H2�����ı��������������������������к�Ӱ�죿(���������С�����䡱)
�������¶ȣ�________��
���������������____________��
�ۼ���������NaCl��Һ��__________��
�ܵ��뼸��CuSO4��Һ��____________��
��2��һ���¶��£���ӦN2(g)��O2(g) ===2NO(g)���ܱ������н��У��ش����д�ʩ�Ի�ѧ��Ӧ���ʵ�Ӱ�졣(���������С�����䡱)
����С���ʹѹǿ����__________��
�ں��ݳ���N2��__________��
�ۺ�ѹ����He��__________��
��3�����淴ӦA(g)��B(g) C(g)��D(g)���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ__________(����ȷѡ��ǰ����ĸ)
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
��4��һ���¶��£���2 L���ܱ������У�X��Y��Z�������������ʱ��仯��������ͼ��ʾ��
�ٴӷ�Ӧ��ʼ��10 sʱ����Z��ʾ�ķ�Ӧ����Ϊ________��X�����ʵ���Ũ�ȼ�����________��Y��ת����Ϊ________��
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƕ���������������ʶ����Ʒ���Ĵ�����ߣ�����Ӧ�÷�ΧԽ��Խ�㡣ij��ѧС����������������������в����ĺ�������(��Ҫ��S��Se��Fe2O3��CuO��ZnO��SiO2��)��ȡ��������������£�
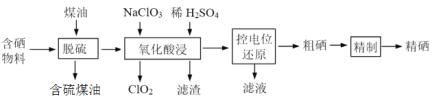
�ش��������⣺
(1)��������ʱ��������������¶ȵı仯��ͼ�������¶ȵ����ߣ������ʳ��������ƣ���ԭ����______������¶���________��

(2)������������У�Seת����H2SeO3���÷�Ӧ�����ӷ���ʽΪ________��
(3)��������[(NH2)2CS]�����������ƽ������ص�λ��ԭ��������λ�ߵ������Ȼ�ԭ����λ�͵����ʱ�������Һ�У��Դﵽ�������ʽ����ķ��롣�±��������������Һ����Ҫ���ӵĵ�λ��

�ٿ��Ƶ�λ��0.740��1.511V��Χ�ڣ����������Һ���������壬��ѡ���Ի�ԭClO2���ù��̵Ļ�ԭ��Ӧ(�뷴Ӧ)ʽΪ___________��
��Ϊʹ�������ʽ������룬���������ƻ�ԭʱ����͵�λӦ������_____V��
(4)�����ľ��ƹ��̣�Na2SO3����[Seת��������������(Na2SeSO3)]��Na2S������H2SO4�ữ�Ȳ��衣
�پ��������Һ��c(Na2S)�ﵽ0.026 mol��L��1����ʱ��Һ�е�c(Cu2+)�����ֵΪ________�������л�������ͭ��[Ksp(CuS)=1.3��10��36]
�������������ữ�������Ļ�ѧ����ʽΪ____________��
(5)�Ծ����ɷֽ���ӫ��������֣�������������Ϊ32 ��g��g��1��������������������Ϊ___________���������������Ϊ0.89%��ȣ����������Խ��͡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ�ڲ�ͬ�����¿���ת�����������,��ͼ,���������������( )
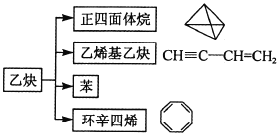
A. �����������һ�ȴ��P���ȴ����ֻ��1��
B. ��Ȳ������ϩ����Ȳ�Ǽӳɷ�Ӧ
C. ![]() �뻷����ϩ(C8H8)��Ϊͬ���칹��
�뻷����ϩ(C8H8)��Ϊͬ���칹��
D. �������ı�����ϩ����Ȳ��ȫȼ��ʱ�ĺ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������{[CH3CH(OH)COO]2Fe��3H2O}(��Է���������288)����������FeCO3��Ӧ�Ƶã���������ˮ�������������Ҵ��������ֽ⣬��һ�ֺܺõIJ�������
I���Ʊ�̼��������װ����ͼ��ʾ��

(1)����B��������_________________________��
(2)ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬��Ŀ���ǣ�__________��Ȼ��رջ���1���������IJ����ǣ�______��C�з�����Ӧ�����ӷ���ʽΪ_____________��
���Ʊ�����������
����FeCO3�����������������Һ����75���½���ʹ֮��ַ�Ӧ��
(3)�÷�Ӧ��ѧ����ʽΪ______��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ����____����Ӧ������������Һ�л��������������ķ����ǣ�_________����ȴ�ᾧ�����ˣ�_________�����
�������������崿�ȵIJ�����
(4)��K2Cr2O7�ζ����ⶨ��Ʒ��Fe2+�ĺ���������Ʒ���ȣ���ȡ6.00g��Ʒ���Ƴ�250��00mL��Һ��ȡ25��00mL��0.0167mol��L-1��K2Cr2O7����Һ�ζ����յ㣬���ı�Һ20��00mL�����Ʒ��������������Ĵ���Ϊ___(������������ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com