
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O ,下列哪一种物质能使上述还原过程发生( )
A.KMnO4B.Na2CO3C.Cu2OD.Fe2(SO4)3
科目:高中化学 来源: 题型:
【题目】科学家首次用X射线微光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
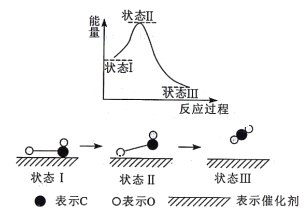
下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,既有旧化学键的断裂又有新化学键的形成
C. CO和O生成了具有极性共价键的CO2
D. 该过程表示CO、O和催化剂的能量之和大于CO2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①﹣⑤中适当的物质,使有连线的两种物质能发生反应.
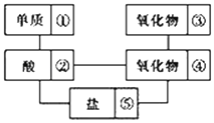
(1)请推断出它们的化学式分别为:①________;②________;③________;④________.
(2)写出下列序号之间反应的化学方程式:
②和④:________;
②和⑤:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置(必要时可加热)进行下列实验,能得出相应实验结论的是
选项 | 甲 | 乙 | 丙 | 实验结论 |
|
A | 苯、液溴 | 铁粉 | AgNO3溶液 | 苯与溴发生取代反应 | |
B | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
C | 浓盐酸 | KMnO4 | 品红溶液 | Cl2具有漂白性 | |
D | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA , 则:
(1)该气体在标准状况下的体积为 ________ L.
(2)该气体在标准状况下的密度为 ________ g/L.
(3)该气体所含原子总数为 ________ 个.
(4)该气体的一个分子的质量为 ________ g.
(5)该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尽管氮元素在地壳中的含量较低(主要以硝酸盐的形式存在),但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为________,雷电作用能进行氮的固定,写出反应方程式________。
(2)食物蕴含的营养物质中,含氮的高分子化合物是_____(填名称,下同),其水解的最终产物为________。
(3)土壤中的NH4+在硝化细菌的催化作用下可被氧化成NO3﹣,写出其离子方程式:________。
(4)某镁铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2L,再向溶液中加入过量氨水,充分反应后过滤.若沉淀质量为40.8g,则合金的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室配制1000mL0.50mol·L-1的Na2CO3溶液,在常用仪器中应选用______mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度______0.50mol·L-1(填“大于”、“小于”或“等于”)。
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在______式滴定管中。若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
则c(HCl)=______mol·L-1。
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若原来配制所称取的Na2CO3固体中混有Na2CO3·10H2O,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:

①请写出AB段反应的离子方程式___________________________________
当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)_____________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com