
����Ŀ�����ܵ�Ԫ���ڵؿ��еĺ����ϵͣ���Ҫ�������ε���ʽ���ڣ������Ǵ������зḻ�ĵ�������Ϊ��������Ĺ㷺Ӧ���ṩ�˿��ܡ�
��1�������ĵ���ʽΪ________���������ܽ��е��Ĺ̶���д����Ӧ����ʽ________��
��2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ�������_____�������ƣ���ͬ������ˮ������ղ���Ϊ________��
��3�������е�NH4+������ϸ���Ĵ������¿ɱ�������NO3����д�������ӷ���ʽ��________��
��4��ijþ���Ͻ�������ϡ������ȫ�ܽ⣬�õ���״����NO 11.2L��������Һ�м��������ˮ����ַ�Ӧ����ˣ�����������Ϊ40.8g����Ͻ������Ϊ________g��
���𰸡� ![]() N2+O2
N2+O2![]() 2NO ������ ������ NH4++2O2
2NO ������ ������ NH4++2O2![]() NO3��+H2O+2H+ 15.3
NO3��+H2O+2H+ 15.3
��������
��1����ԭ�������5�����ӣ�������������ԭ���γ�3�Թ��õ��Ӷԣ������еĵ�������������������·�����Ӧ����һ����������2�����������ɰ��������϶��ɵĺ����ĸ߷��ӻ����������ˮ�����ɶ��Ļ�������Ļ�����ˮ�����ղ���Ϊ�������3��NH4+������ϸ���Ĵ������±������е���������Ϊ��������ӣ����ݵ�ʧ�����غ�д����ѧ����ʽ����4��þ���Ͻ�������ϡ���ᷢ��������ԭ��Ӧ��ת��������þ������������������õ����ӱ���ԭΪNO����Ӧ�����Һ�м�������İ�ˮ��þ����������ȫ��Ӧ����������þ�������������������������غ��������ԭ��Ӧ�е��ӵ�ʧ�غ������
��1��������������ԭ���γ�3�Թ��õ��Ӷԣ�����ʽΪ��![]() ����������������������·�����Ӧ����һ������������ʽΪ��N2+O2
����������������������·�����Ӧ����һ������������ʽΪ��N2+O2![]() 2NO���ʴ�Ϊ��
2NO���ʴ�Ϊ��![]() ��N2+O2
��N2+O2![]() 2NO����2�����������ɰ��������϶��ɵĺ����ĸ߷��ӻ��������ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ�������ˮ�����ɶ��Ļ�������Ļ�����ˮ�����ղ���Ϊ�����ᣬ���Ե�����ˮ������ղ���Ϊ�����ᣬ�ʴ�Ϊ�������ʣ��������3��NH4+������ϸ���Ĵ������±������е��������������ӷ���ʽΪ��NH4++2O2
2NO����2�����������ɰ��������϶��ɵĺ����ĸ߷��ӻ��������ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ�������ˮ�����ɶ��Ļ�������Ļ�����ˮ�����ղ���Ϊ�����ᣬ���Ե�����ˮ������ղ���Ϊ�����ᣬ�ʴ�Ϊ�������ʣ��������3��NH4+������ϸ���Ĵ������±������е��������������ӷ���ʽΪ��NH4++2O2![]() NO3��+H2O+2H+�� �ʴ�Ϊ��NH4++2O2
NO3��+H2O+2H+�� �ʴ�Ϊ��NH4++2O2 ![]() NO3��+H2O+2H+����4����Ͻ���þ�����ʵ���Ϊxmol���������ʵ���Ϊymol����Ӧ��þʧȥ���ӱ�ɶ���þ���ӣ���ʧȥ���ӱ�������ӣ������е�ԭ����+5�۽�ΪNO�е�+2�ۣ�����������ԭ��Ӧ�е�ʧ������ȵĹ�����2x+3y=
NO3��+H2O+2H+����4����Ͻ���þ�����ʵ���Ϊxmol���������ʵ���Ϊymol����Ӧ��þʧȥ���ӱ�ɶ���þ���ӣ���ʧȥ���ӱ�������ӣ������е�ԭ����+5�۽�ΪNO�е�+2�ۣ�����������ԭ��Ӧ�е�ʧ������ȵĹ�����2x+3y=![]() ����5��2��������Һ�м��������ˮ����ַ�Ӧ����ˣ���������Ϊ40.8gΪ������þ������������������������Ԫ���غ����õ���58x+78y=40.8��ã�x=0.3mol��y=0.3mol���Ͻ������=m��Mg��+m��Al��=0.3mol��24g/mol+0.3mol��27g/mol=15.3g���ʴ�Ϊ��15.3��
����5��2��������Һ�м��������ˮ����ַ�Ӧ����ˣ���������Ϊ40.8gΪ������þ������������������������Ԫ���غ����õ���58x+78y=40.8��ã�x=0.3mol��y=0.3mol���Ͻ������=m��Mg��+m��Al��=0.3mol��24g/mol+0.3mol��27g/mol=15.3g���ʴ�Ϊ��15.3��


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ����ܱ�������,������Ӧ:2NO2(g)![]() N2O4(g)������˵����ȷ����
N2O4(g)������˵����ȷ����
A. �������ƽ����Է�����������ʱ,��Ӧ�ﵽƽ��״̬
B. �ﵽƽ���,�������ʵ�Ũ��֮��Ϊ2:1
C. �����¶�,ƽ��״̬���ı�
D. ��ƽ���ѹǿ�ǿ�ʼ��0.8������ת����Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õؿ��й�Ԫ�������Ķ��ֲ�Ʒ���ִ��߿Ƽ���ռ��Ҫλ�ã������ѧ���ִ�������������Ҫ���ã����磺
��1�����ά����Ҫ�ɷ���________
��2��ĿǰӦ������̫���ܵ�صĹ��ת��������________
��3��������Ŀ�ĵ�������һ�����ʶԲ������л�ѧ��ʴ���Ƴɵģ��÷�Ӧ�Ļ�ѧ����ʽΪ________
��4����ҵ����ȡ�ֹ�����ʯӢ�ͽ�̿�ڸ��µ�¯�з�Ӧ�Ƶã��÷�Ӧ���������뻹ԭ����������Ϊ��________����ʯӢ�ͽ�̿�ڸ��µ�¯�з�ӦҲ�����Ƶý��ɰ��SiC����������CO���壬�÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________
��5����������������������������������Һ�У���Ӧ�����ӷ���ʽ�ֱ���________��________
��6������������0.1mol�����ƣ�����������С����ˮ�У���ȫ��Ӧ������ˮ���ռ�����״������������________������ĸ��ţ���
a������1.12L b������1.12L c����1.12L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��ʵ���ϰ��������ͻ�ԭ�������̡�������һ����ԭ���̵ķ�Ӧʽ��NO3��+4H++3e����NO+2H2O ��������һ��������ʹ������ԭ���̷����� ��
A.KMnO4B.Na2CO3C.Cu2OD.Fe2(SO4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�1mol �κ��������Ϊ22.4L����ô�ڱ�״���£�700L NH3 �����ʵ���Ϊ________mol��ȫ���ܽ���1Lˮ�У�������Һ����������Ϊ________������ð�ˮ���ܶ�Ϊ0.85gcm��3 �� ��ˮ�����Ϊ��________L�����ʵ���Ũ��Ϊ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����Ҫ���뻹ԭ������ʵ�ֵ���
A. SO32����SO2B. HCl��Cl2C. Na��Na��D. SO2��S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̸β�Ѫ����ѪֹѪ���ܣ��ṹʽ��ͼ��ʾ�����й��ڴ������˵����������
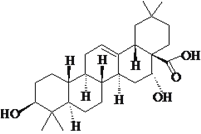
A. ����̼ԭ�Ӷ���ͬһƽ����
B. ������������������к�ͪ��
C. �ܺ�NaHCO3��Һ��Ӧ����CO2
D. �ܷ���ȡ�����������ӳɵȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�д�����б仯�����ֱ���ʽ����������ע����Ӧ�Ļ������͡�
������������ȼ��________��
���ڶ������̵Ĵ��¼��������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ʵ��֤��ͭ��Ũ�����ܷ�����Ӧ��������������������ʣ���ͼ��ʾ�����Թ������2mLŨ���ᣬ�ô����ܺ�һ��С�Ľ����������ӿ��в���һ��ͭ˿�����ȣ��ѷų�����������ͨ��Ʒ����Һ��ʯ����Һ�С���ش��������⣺
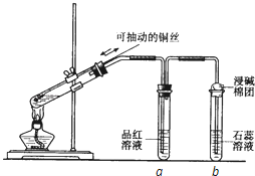
��1��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��________��
��2���Թ�a��b�ֱ����������������ʣ�д���۲쵽�����������á�
�Թ�a�е�������________�� ������________���Թ�b�е�������________��������________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com