
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
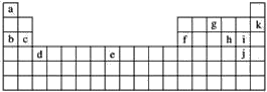
用上表中的字母代号回答下列问题:
(1)属于短周期元素的有__;
(2)属于稀有气体元素的有__;
(3)属于第ⅠA金属元素的有__;
(4)写出c元素在周期表中的位置__。
【答案】a、b、c、f、g、h、i、k k b 第三周期第ⅡA族
【解析】
根据各元素在周期表中的相对位置可知a为H,b为Na,c为Mg,f为Al,g为N,k为Ne,h为S,i为Cl,j为Br,d为Sc,e为Fe;
(1)短周期为第一第二第三周期;
(2)稀有气体为零族元素,包括氦,氖,氩,氪,氙,氡;
(3)属于第ⅠA族元素的元素有氢,锂,钠,钾,铷,铯,钫,氢属于非金属元素;
(4)主族元素周期数等于电子层数,最外层电子数等于族序数。
根据各元素在周期表中的相对位置可知a为H,b为Na,c为Mg,f为Al,g为N,k为Ne,h为S,i为Cl,j为Br,d为Sc,e为Fe;
(1)短周期为第一第二第三周期,属于短周期元素的有a、b、c、f、g、h、i、k,
故答案为:a、b、c、f、g、h、i、k;
(2)属于稀有气体元素的有Ne,
故答案为:k;
(3)属于碱金属元素的有Na,
故答案为:b;
(4)主族元素周期数等于电子层数,最外层电子数等于族序数。元素c在周期表中的位置是第三周期第ⅡA族,
故答案为:第三周期第ⅡA族。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种安全可充电的柔性水系钠离子电池,可用生理盐水或细胞培养基为电解质,电池放电的总反应式为:Na0.44MnO2+NaTi2(PO4)3=Na0.44-xMnO2+Na1+xTi2(PO4)3,其工作原理如下图。

下列说法错误的是
A. 放电时,Cl-向X极移动
B. 该电池充电时Y极应该与电源的正极相连
C. 充电时,阴极反应为:NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. 该电池可能作为可植入人体的电子医疗设备的电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
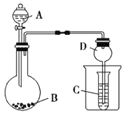
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
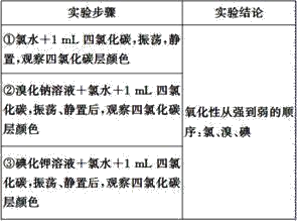
实验药品:溴化钠溶液、碘化钾溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是__、__。
(2)②中反应的化学方程式为__;③中反应的离子方程式为__。
(3)四氯化碳在实验中所起的作用是__。
(4)该同学的实验设计不足之处是__,改进的办法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知28 g CuO和MgO的固体混合物与200 mL某H2SO4溶液恰好完全反应,将反应后的溶液小心蒸干,得到固体68 g。则原H2SO4溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
A.2.5 mol·L-1 28.57%B.2.2 mol·L-1 23.07%
C.1.5 mol·L-1 24.55%D.2.5 mol·L-1 18.37%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现实验室需要用质量分数:98%、密度:1.84g/cm3的浓硫酸配制240mL4.6mol/L的稀硫酸,下列说法中正确的是( )
A.该浓硫酸的物质的量浓度为18.4mol/L
B.需要该浓硫酸的体积为60mL。
C.配制稀硫酸时,将量好的浓硫酸注入容量瓶中,并加入适量的水
D.该同学实际配制得到的浓度为4.8mol/L,可能的原因是量筒量取浓硫酸时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。
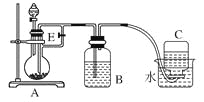
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com