
| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
科目:高中化学 来源: 题型:选择题
| A. | 该反应是焓变为正值 | |
| B. | 恒温恒容下,充入更多的CO2,能提高H2的转化率 | |
| C. | 升高温度,正、逆反应速率均增大 | |
| D. | 该反应化学方程式为:CO+H2O$?_{△}^{催化剂}$ CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子数增多,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数不一定增大,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水与醋酸的反应:NH3•H2O+CH3COOH=CH3COO-+NH4 ++H2O | |
| B. | 大理石与盐酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+OH-+Ba2+=BaSO4↓+H2O | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 项目 | 甲 | 乙 | A |
| 起始时 | 3mol/L | 3mol/L | 0 |
| 2s末 | 1.8mol/L | 2.6mol/L | 0.8mol/L |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
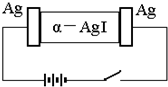 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com