
| A. | 该反应是焓变为正值 | |
| B. | 恒温恒容下,充入更多的CO2,能提高H2的转化率 | |
| C. | 升高温度,正、逆反应速率均增大 | |
| D. | 该反应化学方程式为:CO+H2O$?_{△}^{催化剂}$ CO2+H2 |
分析 平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数K是指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,所以该反应化学方程式应为CO2+H2?CO+H2O.
A、恒容时,温度升高,H2浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动;
B、充入更多的CO2,即增大反应物浓度,平衡正向移动,所以能提高H2的转化率;
C、温度升高,正逆反应速率都增大;
D、根据平衡常数表达式书写反应方程式.
解答 解:平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,所以该反应化学方程式应为CO2+H2?CO+H2O.
A、恒容时,温度升高,H2浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即该反应的焓变为正值,故A正确;
B、充入更多的CO2,即增大反应物浓度,平衡正向移动,所以能提高H2的转化率,故B正确;
C、温度升高,正逆反应速率都增大,故C正确;
D、平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,所以该反应化学方程式应为CO2+H2?CO+H2O,故D错误;
故选D.
点评 本题考查化学反应速率、化学平衡、平衡常数等,难度中等,化学反应速率和化学平衡问题一直是高考命题的热点,对化学平衡常数的考查已成为近年来高考命题的热点之一,命题主要考查的内容为求算化学平衡常数和影响因素,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 化学键既存在于相邻原子间又存在于相邻分子间 | |
| B. | 两个原子间的相互作用叫化学键 | |
| C. | 化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用 | |
| D. | 化学键的实质是静电吸引 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
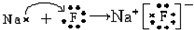 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐桥在电化学中可导通左右半池,其作用和用铜导线连接完全一致 | |
| B. | 室温时,酸碱中和滴定的终点刚好是pH=7的点 | |
| C. | pH计和广泛pH试纸的精确度一致,只是pH计使用更方便 | |
| D. | 向某溶液中滴入2滴黄色的K3[Fe(CN)6]溶液,若有蓝色沉淀生成,则溶液中一定含有 Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
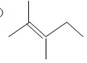
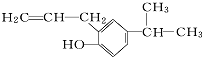 的分子式为C12H16O.
的分子式为C12H16O. 分子中至少有11个碳原子处于同一平面上.
分子中至少有11个碳原子处于同一平面上.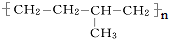 的单体为
的单体为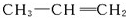 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
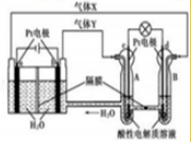
| A. | 气体X为O2 | |
| B. | c电极为负极,发生的电极反应式为H2-2e-=2H+ | |
| C. | 一段时间后A处PH降低 | |
| D. | 当有0.4mol电子转移时,在B极上生成标准状况下气体2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92.3% | B. | 87.6% | C. | 75% | D. | 84.9% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
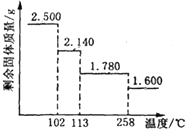 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )| A. | 晶体从常温升至105℃的过程中只有氢键断裂 | |
| B. | 受热过程中,胆矾晶体中形成配位键的4个水分子同时失去 | |
| C. | 120℃时,剩余固体的化学式是CuSO4•H2O | |
| D. | 按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子所处化学环境可以分为3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com