
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

分析 (1)依据反应②平衡常数随温度变化分析判断平衡移动方向,图表中的数据可知平衡常数随温度升高而增大;
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系分析,温度不变平衡常数不变;书写反应①②③的平衡常数表达式,结合特征就是得到反应③的平衡常数,分析反应特征可知平衡常数K3=K1×K2;
(3)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
(4)甲醇燃料电池中燃料在负极失电子发生氧化反应,碱溶液中甲醇失电子生成碳酸根离子;
解答 解:(1)图表中反应②平衡常数随温度变化,500°C变化到800°C,平衡常数从1.0变化为2.5,温度升高平衡常数增大,平衡正向进行,说明正反应是吸热反应;
故答案为:吸热;
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系分析,平衡状态由A变到B时温度不变,平衡常数不变,K(A)=K(B),
①2H2(g)+CO(g)?CH3OH(g),平衡常数K1=$\frac{[C{H}_{3}OH]}{[{H}_{2}]^{2}[CO]}$,②2H2(g)+CO2(g)?H2O+CO(g),平衡常数K2=$\frac{[CO][{H}_{2}O]}{[{H}_{2}]^{2}[C{O}_{2}]}$
依据反应①+②得到反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g),平衡常数K3=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[{H}_{2}]^{3}[C{O}_{2}]}$=$\frac{[C{H}_{3}OH]}{[{H}_{2}]^{2}[CO]}$×$\frac{[CO][{H}_{2}O]}{[{H}_{2}]^{2}[C{O}_{2}]}$,所以平衡常数K3=K1×K2,
故答案为:=,K1•K2;
(3)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂,当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ时容器体积为3L,一氧化碳浓度为3mol/L,改变条件变化为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合,
故答案为:加入催化剂,将容器的体积快速压缩至2L;
(4)甲醇燃料电池中燃料在负极失电子发生氧化反应,碱溶液中甲醇失电子生成碳酸根离子,负极电极反应为:CH3OH-6 e-+8 OH-=CO32-+6 H2O,
故答案为:CH3OH-6 e-+8 OH-=CO32-+6 H2O;
点评 本题考查了化学平衡常数、化学平衡影响因素、图象变化特征的分析,原电池原理的应用,主要是弱电解质电离平衡常数的计算,题目难度中等.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
| 加入试剂 | 被检出物质 | 理由 |
| 水 | CuSO4 | CuSO4溶于水溶液显蓝色 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| CuSO4 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
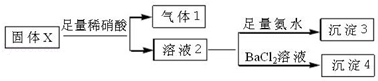
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3和KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置依据U管两边液面的高低判断Na和水反应的热效应 | |
| B. | 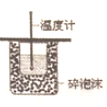 装置依据测定酸碱中和反应的中和热 | |
| C. | 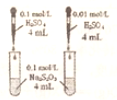 装置依据出现浑浊的先后顺序,比较浓度对反应速率的影响 | |
| D. | 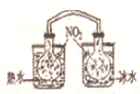 装置依据两容器内气体颜色变化,判断反应2NO${\;}_{{2}_{\;}}$(g)?N2O4(g)平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com