


| n |
| V |
ag×
| ||
| 10 |
| 0.07ag | ||
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 目标生成物的质量 |
| 参加该反应所有反应物的总质量 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲醛分子中含C-H键数目为2NA |
| B、常温常压下,7g乙烯分子的数目为0.5NA |
| C、25℃,pH=2的盐酸中含有H+的数目为0.01NA |
| D、标准状况下,2.24L氯气与1.12L液态水反应转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、53gNa2CO3固体含有的CO32-离子数为0.5 NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的共价键数目为3NA |
| D、5.6 g Fe和一定量的浓HNO3或稀HNO3完全反应,转移电子一定均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Fe3+和28g的Si都含有NA个原子 |
| B、标况下,22.4 L的空气中含有NA个单质分子 |
| C、1mol Cl2参加反应时,转移的电子数可能是2NA个 |
| D、含有NA个Na的金属钠,投入1L H2O中,所得溶液的物质的量浓度为1 mol/l |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是A~O的转化关系.已知A、F是金属单质,B、C、D、E、H、I、J、K常温常压下均为气体,且B、C、D、E是单质,I是一种红棕色气体,G是一种淡黄色固体,M的水溶液遇硫氰化钾溶液显红色,J与K相遇会产生大量白烟.请回答下列问题:
如图是A~O的转化关系.已知A、F是金属单质,B、C、D、E、H、I、J、K常温常压下均为气体,且B、C、D、E是单质,I是一种红棕色气体,G是一种淡黄色固体,M的水溶液遇硫氰化钾溶液显红色,J与K相遇会产生大量白烟.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
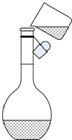 实验室中需要配制500mL0.10mol/L的NaOH溶液.回答下列问题.
实验室中需要配制500mL0.10mol/L的NaOH溶液.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,48gO3含有的原子数为3NA |
| B、1L 1mol/L 的CH3COOH溶液中含有的CH3COO-的数目为NA |
| C、11.2 L氧气所含的原子数为NA |
| D、5.6g铁与盐酸完全反应时失去的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断搅拌 |
| B、蒸发溶液时有液体飞溅,应立即加水冷却 |
| C、将酒精灯熄灭后,再向其中补充酒精至适量 |
| D、金属钠、钾着火时,应立即用沙子或湿抹布扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com