
| A. | 丙烯的结构简式:C3H6 | |
| B. | Al3+能水解成Al(OH)3胶体,明矾可用作净水剂 | |
| C. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| D. | 盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
分析 A、烯烃中的碳碳双键不能省略;
B、Al3+能水解成Al(OH)3胶体,氢氧化铝胶体具有吸附性;
C、在海轮外壳上镶入锌块,能形成原电池,在原电池中锌做负极;
D、被KCl饱和溶液浸泡过的琼脂能够传递电荷.
解答 解:A、烯烃中的碳碳双键不能省略,故丙烯的结构简式为CH2=CHCH3,故A错误;
B、Al3+能水解成Al(OH)3胶体,氢氧化铝胶体具有吸附性,能除去水中的杂质,故明矾能净水,故B正确;
C、在海轮外壳上镶入锌块,能形成原电池,在原电池中锌做负极,对轮船起到保护的作用,即牺牲阳极的阴极防护法,故C正确;
D、被KCl饱和溶液浸泡过的琼脂能够传递电荷,所以可用作原电池的盐桥,故D正确;
故选A.
点评 本题考查的知识点较多,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握明矾净水的原理,难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 测0.1mol•L-1氨水的pH为11,是因为NH2•H2O?NH4++OH- | |
| C. | 0.01mol•L-1NaHCO3溶液中溶质的电离方程式为Na++H++CO32- | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| C. | 苯与浓硝酸、浓硫酸混合共热制取硝酸苯是发生取代反应 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
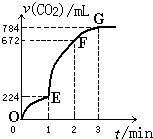 常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).
常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaO | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
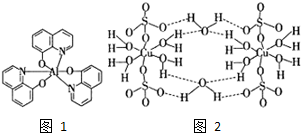 2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.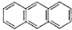 ,平面结构)属于非极性(填“极性”或“非极性”)分子.
,平面结构)属于非极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
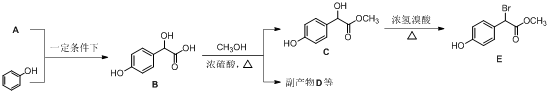
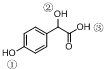 中①、②、③3个-OH的酸性由强到弱的顺序为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺序为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式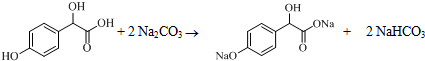 .
.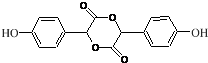 .
.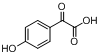 ,写出对应各步反应中依次所需的试剂和反应条件NaOH溶液;Cu、O2、加热;盐酸溶液.
,写出对应各步反应中依次所需的试剂和反应条件NaOH溶液;Cu、O2、加热;盐酸溶液.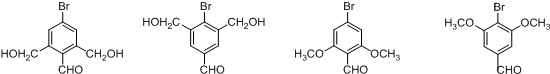 (不考虑立体异构).
(不考虑立体异构).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com