
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)该混合气体中CO和CO2的物质的量之比为_________。
(3)混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(4)将混合气体依次通过如下图所示装置,最后收集在气球中(体积在标准状况下测定)。

①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
【答案】36g/mol 1:10.4NA28g/mol2.8NA
【解析】
(1)混合气体的物质的量为8.96L÷22.4L/mol=0.4mol,则根据M=m/n可知混合气体的平均摩尔质量为14.4g÷0.4mol=36g/mol。
(2)设混合气体中CO和CO2的物质的量分别是x mol、y mol,则x+y=0.4、28x+44y=14.4,解得x=y=0.2,所以该混合气体中CO和CO2的物质的量之比为1:1;
(3)1个CO、CO2中都含1个碳原子,则混合气体中碳原子物质的量为0.4mol,碳原子数为0.4NA。
(4)气体通过NaOH溶液时CO2被吸收,通过浓硫酸时H2O(g)被吸收,最后收集在气球中的气体为CO。则
①收集在气球中的气体为CO,CO的摩尔质量为28g/mol。
②1个CO分子中含14个电子,则气球中收集到的CO气体所含电子物质的量为0.2mol×14=2.8mol,电子数为2.8NA。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

(1)N电极的电极反应式为______________________.
(2)请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:______________
Cr2O72+ Fe2++ ═ Cr3++ Fe3++
(3)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105molL﹣1 时,Cr3+沉淀完全,此时溶液的pH=_______. (已知,Ksp=6.4×1031,lg2=0.3)
(4)若燃料电池改用KOH溶液作电解质溶液,则M极的电极反应式为:____________________
(5)已知H2B在溶液中的电离方程式:H2B=H++HB﹣,HB﹣H++B2﹣.下列叙述一定正确的是(____)
A.Na2B溶液存在H2B B.NaHB溶液一定显碱性
C.NaHB溶液一定显酸性 D.NaHB溶液与稀盐酸反应的离子方程式是HB﹣+H+=H2B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
I、(1)联氨分子的电子式为______________,
(2)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的方程式_______________。联氨与盐酸反应生成的正盐的化学方程式为__________________
II、某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl

实验一:制备NaClO溶液(实验装置如上图所示)
(1)配制30%NaOH溶液时,所需的玻璃仪器除量筒外,还有________(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
实验二:制取水合肼(实验装置如右图所示)。

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是__________________________________________________
实验三:测定馏分中水合肼的含量。
称取馏分5.000 g,加入适量NaHCO3固体,加水配成250 mL溶液,移取25.00 mL,用0.100 0 mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5 左右。(已知:N2H4·H2O+2I2===N2↑+4HI+H2O)
(3)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_____________________。
(4)本实验用____________做指示剂,当滴定达到终点时的现象为_____________________。
(5)实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
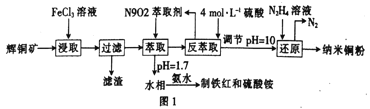
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为____________________________。
(2)从辉铜矿中浸取铜元素时,可用FeCl 3溶液作浸取剂。
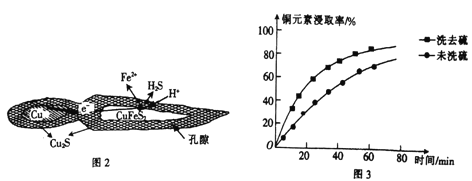
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl下标2+S,每生成1molCuCl2,反应中转移电子的物质的量为_____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是________________。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_________________。

(4)用“反萃取”得到的CuSO4 溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_____。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、____等操作可得到Fe2O3 产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B. 用向下排空气法可以收集到纯净的氯气
C. 贮氯罐意外泄漏,应沿逆风方向疏散群众
D. 氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列原子:①12C;②39K;③40Ca;④13C;⑤14N;⑥40Ar。请回答下列问题(填写相应的序号):
(1)互为同位素的是___。
(2)中子数相等,但质子数不相等的是___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.所有物质中一定存在化学键
B.含共价键的化合物不一定是共价化合物
C.金属元素和非金属元素形成的化合物一定是离子化合物
D.溶于水能导电的化合物就是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com