
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
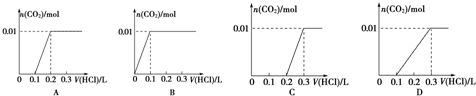
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的平均反应速率为0.15mol/(L?min) |
| B、恒温达到平衡时容器内压强为开始时的85% |
| C、B的转化率为10% |
| D、平衡时A的浓度为0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
 ;△H1
;△H1查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向粗盐溶液中滴加盐酸和BaCl2溶液,产生白色沉淀,则说明粗盐中含有SO42- |
| B、向精盐溶液中滴加盐酸和BaCl2溶液,无明显现象,则说明精盐中不含SO42- |
| C、向蒸馏水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明蒸馏水中含有Cl- |
| D、向自来水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明自来水中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3>NaHCO3 |
| B、常温时在水中的溶解度:NaHCO3>Na2CO3 |
| C、与稀盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
| D、等质量的固体与足量盐酸反应放出CO2的质量:Na2CO3>NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com