
| 1 |
| 4 |
| 1 |
| 2 |
| A、A中的颜色比B中的浅 |
| B、A中的颜色比B中的深 |
| C、A中的颜色与B中的深浅相同 |
| D、A中颜色比开始时深 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1:1 | B、8:5 |
| C、5:8 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B、硅酸盐NaAISiO4.nH2O可改写成氧化物形式为:Na2O.AI2O3.2SiO2.2nH2O |
| C、AI65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D、过量铁与浓硫酸加热反应可以得到氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入NaOH溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g)平衡体系,增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 |
| D、工业合成氨工艺中,采用较高的压强来提高原料的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正向移动 |
| B、重新达到平衡时PCl5转化率增大 |
| C、重新达到平衡后PCl3体积分数减小 |
| D、反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
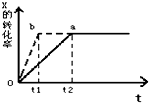 图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )
图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )| A、增大Y的浓度 |
| B、加入催化剂 |
| C、降低温度 |
| D、增大体系压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com