
| X | Y | |
| Z | W |
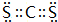 ,故答案为:
,故答案为: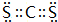 ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| 1 |
| 4 |
| 1 |
| 2 |
| A、A中的颜色比B中的浅 |
| B、A中的颜色比B中的深 |
| C、A中的颜色与B中的深浅相同 |
| D、A中颜色比开始时深 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B、图②装置的盐桥中KCl的Cl-移向甲烧杯 |
| C、图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D、装置④中Ag电极发生反应:2H2O+2e-=H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应:C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | ||
B、一定温度下,反应:MgO(l)═Mg(l)+
| ||
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | ||
| D、已知反应:C(s)+H2O(g)→CO(g)+H2(g)△H=+131.4kJ,该反应在常温下一定可自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在自然界中只以化合态的形式存在 |
| B、单质常用作半导体材料和光导纤维 |
| C、最高价氧化物不与任何酸反应 |
| D、气态氢化物很稳定,受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
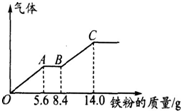 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、H2SO4浓度为2.5 mol?L-1 |
| B、第二份溶液中最终溶质为FeSO4 |
| C、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| D、原混合酸中NO3-物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4 g |
| B、3.2 g |
| C、6.4 g |
| D、9.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
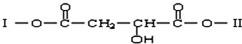
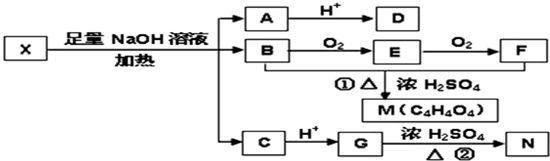
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com