
 H2↑+Cl2↑+2NaOH,
H2↑+Cl2↑+2NaOH, =1mol,含水为
=1mol,含水为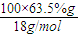 =3.5mol,
=3.5mol, 2H2+O2,
2H2+O2, =1mol,相当于电解HCl即2HCl
=1mol,相当于电解HCl即2HCl H2↑+Cl2↑,
H2↑+Cl2↑, =3.5mol,由此知还应该有水的电解,即2H2O
=3.5mol,由此知还应该有水的电解,即2H2O 2H2+O2,
2H2+O2, H2↑+Cl2↑,
H2↑+Cl2↑, 2H2+O2
2H2+O2

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2013届福建省安溪一中高三上学期期末考试化学试卷(带解析) 题型:填空题
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:

(1)反应
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质.量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数___ _(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由__ __极移向___ _极(填“正”或“负”);电池的正极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:

(1)反应
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:

①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质.量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数___ _(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由__ __极移向___ _极(填“正”或“负”);电池的正极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com