
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数,等于电子层数。 |
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.②④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| M | M的一种核素的质量数为63,中子数为34 |
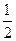 O2(g)= XO2(g) △H =" -283.0" kJ·mol-1
O2(g)= XO2(g) △H =" -283.0" kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据价电子构型与化合价的关系,推出最外层电子数3个的元素一定是第ⅢA族元素 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KCl中含有35Cl | B.KCl中含有37Cl |
| C.生成物Cl2的相对分子质量大于71 | D.该反应转移的电子数为6e- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.发生化学反应时,失去电子越多的金属原子,其还原能力越强 |
| B.目前已发现113种元素,即已发现113种原子 |
| C.核外电子总数不同的原子,可能是同种元素的原子 |
| D.同一元素的各种同位素的化学性质基本相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com