
【题目】【2016全国卷1】298 K时,在20.0 mL 0.10 mol![]() 氨水中滴入0.10 mol
氨水中滴入0.10 mol![]() 的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol![]() 氨水的电离度为1.32%,下列有关叙述正确的是
氨水的电离度为1.32%,下列有关叙述正确的是
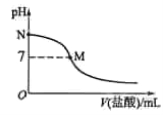
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
【答案】D
【解析】
试题分析:A.把盐酸滴加到氨水中,开始时溶液显碱性,当滴定达到终点时,溶液由碱性变为酸性,根据人视觉有滞后性,观察溶液的颜色由浅到深比较敏锐,所以为减小滴定误差,在该滴定过程应该选择甲基橙作为指示剂更精确些,不应该选择酚酞作为指示剂,错误;B.如果二者恰好反应,则会生成氯化铵,氯化铵是强酸弱碱盐,NH4+水解使溶液显酸性,因此M点pH=7,则M点对应的盐酸体积小于20.0 mL,错误;C.根据电荷守恒可得:c(NH4+)+ c(H+)=c(Cl-)+c(OH-)。由于M点处的溶液显中性,c(H+)=c(OH-),所以c(NH4+)=c(Cl-)。盐是强电解质,电离远远大于弱电解质水的电离程度,所以溶液中离子浓度关系是:c(NH4+)=c(Cl-)>c(H+)=c(OH-),错误;D.N点氨水溶液中已经电离的一水合氨浓度等于溶液中氢氧根离子的浓度,c(OH-)=0.1 mol/L×1.32%=1.32×103 mol/L,根据水的离子积常数可知:N处的溶液中氢离子浓度=![]() =7.6×10-12 mol/L,根据pH=lgc(H+)可知此时溶液中pH<12,正确。
=7.6×10-12 mol/L,根据pH=lgc(H+)可知此时溶液中pH<12,正确。


科目:高中化学 来源: 题型:
【题目】【2017届河南省南阳一中高三上周考五】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铝有较高熔点,可做耐火材料
B. SO2能使溴水褪色,体现其漂白性
C. 氨气是电解质,因为氨气的水溶液能导电
D. 钠钾合金可用于快中子反应堆的热交换剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A. 液化石油气的主要成分 B. 含碳质量分数最大的有机物
C. 最简单的有机物 D. 1mol甲烷含有8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是:
A. a = b
B. 混合溶液的pH = 7
C. 混合溶液中,c(H+) =![]() mol/L
mol/L
D. 混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是
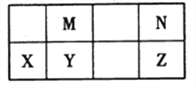
A. 氢化物的稳定性:N >Z,是因为其氢化物分子可形成氢键
B. 元素的非金属性:M > Y,是因为单质M能与YN2反应生成单质Y
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti中,价电子排布式为____,价电子排布图为____
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3,实现储氢和输氢。下列说法正确的是_____;
2NH3,实现储氢和输氢。下列说法正确的是_____;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为__________,
SnBr2分子中 Sn-Br的键角______120°(填“>”“<”或“=”)。
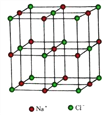
(4) NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是_______。
已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏加德罗常数的值, 则NiO 晶体的密度为_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H7N9型禽流感是一种新型禽流感,浙江自2015年入秋以来,已累计报告人感染H7N9禽流感4例。研究表明,该病毒对热敏感,煮沸2分钟以上即可失去活性,许多常用消毒药物如:高锰酸钾、漂白粉、氯气等,也都可以将该病毒杀灭。
(1)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是___________;过一会儿,溶液颜色逐渐褪去,起作用的微粒是______________。
请写出氯气与水反应的离子方程式_____________________。
(2)工业上制取漂白粉的反应方程式为:__________________。
(3)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4 + 16HCl ![]() 2MnCl2 + 2KCl + 8H2O + 5Cl2↑,该反应中氧化剂为____________。
2MnCl2 + 2KCl + 8H2O + 5Cl2↑,该反应中氧化剂为____________。
(4)向漂白粉清液中滴加碳酸钠溶液,有白色沉淀生成,写出发生反应的离子方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com