
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
【答案】![]() +H2O
+H2O![]() +OH 3
+OH 3![]() +Fe3+=Fe(OH)3↓+3CO2↑ 小于 PbSO4(s)+
+Fe3+=Fe(OH)3↓+3CO2↑ 小于 PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+
等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大
向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大 ![]() +H+=
+H+=![]() Na+、Cl-、
Na+、Cl-、![]()
【解析】
(1)碳酸钠溶液中碳酸根离子水解,使得溶液显碱性;
(2)在FeCl3溶液中加入碳酸氢钠浓溶液,二者发生双水解反应,生成氢氧化铁红褐色沉淀和二氧化碳无色气体;
(3)用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,发生了沉淀的转化,PbSO4+ Na2CO3![]() PbCO3+ Na2SO4,结合平衡移动的影响因素分析解答;
PbCO3+ Na2SO4,结合平衡移动的影响因素分析解答;
(4)根据图象,随着盐酸的加入,![]() 逐渐减少,
逐渐减少,![]() 逐渐增多,到B点时,
逐渐增多,到B点时,![]() 完全反应,
完全反应,![]() 达到最多,随后
达到最多,随后![]() 逐渐减少,碳酸分子逐渐增多,据此分析解答。
逐渐减少,碳酸分子逐渐增多,据此分析解答。
(1)常温下,0.1mol/L碳酸钠溶液中碳酸根离子水解,使得溶液显碱性,水解的离子方程式为![]() +H2O
+H2O![]() +OH,故答案为:
+OH,故答案为:![]() +H2O
+H2O![]() +OH;
+OH;
(2)在FeCl3溶液中加入碳酸氢钠浓溶液,二者发生双水解反应,生成氢氧化铁红褐色沉淀和二氧化碳无色气体,反应的离子方程式为3![]() +Fe3+=Fe(OH)3↓+3CO2↑,故答案为:3
+Fe3+=Fe(OH)3↓+3CO2↑,故答案为:3![]() +Fe3+=Fe(OH)3↓+3CO2↑;
+Fe3+=Fe(OH)3↓+3CO2↑;
(3)①用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,发生了沉淀的转化:PbSO4+ Na2CO3+PbCO3+ Na2SO4,说明PbCO3的溶解度小于PbSO4,故答案为:小于;
②用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,发生了沉淀的转化:PbSO4+ Na2CO3 PbCO3+ Na2SO4,离子方程式为PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() ,故答案为:PbSO4(s)+
,故答案为:PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() ;
;
③等体积、等浓度的Na2CO3和NaHCO3溶液中,Na2CO3中的c(CO32-)大,能够使PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 的平衡正向移动的程度增大,因此Na2CO3溶液中的PbSO4转化率较大,故答案为:等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+
的平衡正向移动的程度增大,因此Na2CO3溶液中的PbSO4转化率较大,故答案为:等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大;
向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大;
(4)①根据图象,随着盐酸的加入,![]() 逐渐减少,
逐渐减少,![]() 逐渐增多,到B点时,
逐渐增多,到B点时,![]() 完全反应,
完全反应,![]() 达到最多,随后
达到最多,随后![]() 逐渐减少,碳酸分子逐渐增多,因此OAB段碳酸钠与盐酸反应生成碳酸氢钠,反应的离子方程式为
逐渐减少,碳酸分子逐渐增多,因此OAB段碳酸钠与盐酸反应生成碳酸氢钠,反应的离子方程式为![]() +H+=
+H+=![]() ,故答案为:
,故答案为:![]() +H+=
+H+=![]()
②根据图象,当pH=7时,碳酸钠完全转化为碳酸氢钠,且部分碳酸氢钠与盐酸反应生成了碳酸,此时溶液中主要存在碳酸氢钠、氯化钠和碳酸,存在的离子主要有Na+、Cl-、![]() ,故答案为:Na+、Cl-、
,故答案为:Na+、Cl-、![]() 。
。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,体积一定的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应达到平衡时,X的转化率为50%
D.反应起始时和达平衡时的压强比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+价电子排布式为___________;[Cu(NH3)4]SO4·H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为___________。
(2)SO42-中S原子轨道杂化类型为___________,H3O+几何构型为___________。
(3)NH3极易溶于H2O中,可能的原因为___________。
(4)N、O、S第一电离能由大到小的顺序为___________。

(5)Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag·cm-3,则Cu与F最近距离为___________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是![]()
①稀豆浆、硅酸、氧化铁溶液都属于胶体
②纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
③明矾、冰水混合物、四氧化三铁都不是混合物
④![]() 、MgO、
、MgO、![]() 均属于碱性氧化物
均属于碱性氧化物
⑤葡萄糖、油脂都不属于有机高分子
⑥电解熔融的![]() 可制得金属铝
可制得金属铝
A.①②B.②③C.③⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________。
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有_____________。
(3)现代工业冶金中,2Au(CN)![]() +Zn=2Au+Zn(CN)
+Zn=2Au+Zn(CN)![]() 。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如CH3CH2OH![]() CH3CHO+H2O。CH3CH2OH的沸点高于CH3CHO的主要原因是_____________________________________________。
CH3CHO+H2O。CH3CH2OH的沸点高于CH3CHO的主要原因是_____________________________________________。
(5)一种铜镍合金(俗称白铜)的晶胞如图所示,铜、镍原子个数比为___________。
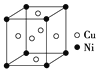
(6)金晶胞如图所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(φ)为___________ (用含π的式子表示),(提示原子空间利用率=![]() )。
)。
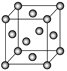
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有0.1mol·L1的四种溶液:①CH3COOH②NH3·H2O③HCl④FeCl3
(1)用化学用语解释②呈碱性的原因:______。
(2)溶液③的pH=______。
(3)加热、蒸干、灼烧④后所得的产物是______。
(4)25℃时,向20mL①中不断滴入0.1mol·L1的NaOH溶液,混合溶液pH变化如图所示:
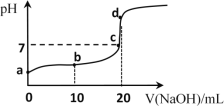
①a点水电离出的c(H+)______10-7mol·L1(填“大于”“小于”或“等于”)
②b点发生反应的离子方程式是______。
③c点溶液中存在的离子的浓度大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
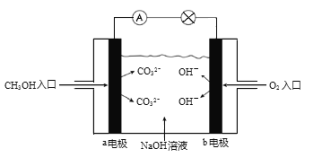
【题目】工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为 1L 的恒温密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示:
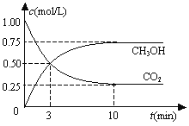
(1)达到平衡的时刻是_________min(填“3”或“10”)。在前10min内,用CO2浓度的变化表示的反应速率υ(CO2)=_________mol/(L· min)。
(2)能判断该反应达到化学平衡状态的依据是_________。
a.容器内压强不变 b.混合气体中c(CO2)不变 c.υ(CH3OH)=υ(H2O) d.c(CH3OH)=c(H2O)
(3)达平衡后,H2的转化率是_________。平衡常数 K =_________(计算结果保留一位小数)。为了提高H2的转化率,可采取_________(填“增大”或“减小”)CO2浓度的措施。
(4)工业上也可用 CO 和H2合成甲醇
已知:①CO(g) + ![]() O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + ![]() O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + ![]() O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
则反应CO(g) + 2H2(g) = CH3OH(g)△H=_________kJ/mol
(5)如图是甲醇燃料电池原理示意图,电池正极的电极反应式为:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com