
【题目】工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为 1L 的恒温密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示:
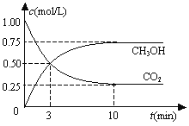
(1)达到平衡的时刻是_________min(填“3”或“10”)。在前10min内,用CO2浓度的变化表示的反应速率υ(CO2)=_________mol/(L· min)。
(2)能判断该反应达到化学平衡状态的依据是_________。
a.容器内压强不变 b.混合气体中c(CO2)不变 c.υ(CH3OH)=υ(H2O) d.c(CH3OH)=c(H2O)
(3)达平衡后,H2的转化率是_________。平衡常数 K =_________(计算结果保留一位小数)。为了提高H2的转化率,可采取_________(填“增大”或“减小”)CO2浓度的措施。
(4)工业上也可用 CO 和H2合成甲醇
已知:①CO(g) + ![]() O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + ![]() O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + ![]() O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
则反应CO(g) + 2H2(g) = CH3OH(g)△H=_________kJ/mol
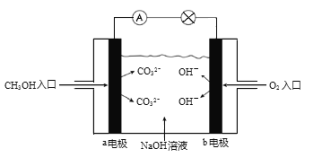
(5)如图是甲醇燃料电池原理示意图,电池正极的电极反应式为:_________。
【答案】10 0.075 ab 75% 5.3 增大 -93.6 ![]()
【解析】
(1)达到平衡时是物质的浓度保持不变而不是相等,故平衡的时刻是10min,在前10min内,用 CO2浓度的变化表示的反应速率 υ(CO2)=![]() ,故答案为:10 0.075
,故答案为:10 0.075
(2) a.该反应的正反应气体分子数减小,建立平衡过程中气体分子物质的量是变化的,在恒容容器中,容器内的压强是变化的,故容器内压强不变能说明反应达到平衡状态;
b.混合气体中c(CO2)不变是反应达到平衡状态的特征;
c.υ(CH3OH)=υ(H2O) 没有指明反应速率的方向,不能说明正、逆反应速率相等,不能说明反应达到平衡状态;
d.从正反应开始建立平衡的过程中c(CH3OH)与c(H2O)始终相等,c(CH3OH)与c(H2O)不能说明反应达到平衡状态;
故答案为:ab;
(3)通过化学平衡三段式进行计算,可知:
H2的转化率=![]() ;平衡常数
;平衡常数 ![]() ;增大一种反应物的浓度,另一种反应物的转化率增大,故为了提高 H2 的转化率,可采取增大CO2 浓度,故答案为:75% 5.3 增大;
;增大一种反应物的浓度,另一种反应物的转化率增大,故为了提高 H2 的转化率,可采取增大CO2 浓度,故答案为:75% 5.3 增大;
(4) ①CO(g) + ![]() O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + ![]() O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + ![]() O2(g) = CO2(g)+2H2O(g) △H3=-673 kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673 kJ/mol
根据盖斯定律,将①+2×②-③即得到反应 CO(g) + 2H2(g) = CH3OH(g)![]() ,故答案为:-93.6;
,故答案为:-93.6;
(5)根据甲醇燃料电池原理示意图,电解质是NaOH溶液,故电池正极的电极反应式为:![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
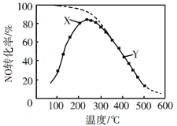
A.反应2NO(g)+O2(g)=2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K<2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。
(1)将工业废气中的二氧化碳转化为甲醇,其原理是:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol。308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。
H2O(g)+CH3OH(g) △H=-53.7kJ/mol。308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。
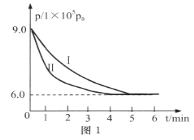

①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______。
②若其他条件相同时,只改变某一条件,曲线变化为II,则改变的条件是_____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
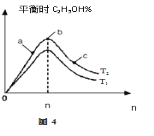
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时,CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g)的平衡常数K=_____。
H2O(g)+CH3OH(g)的平衡常数K=_____。
②某科研小组采用反应Ⅱ来合成甲醇,在450℃时,研究了n(H2):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图3),则图中表示n(H2):n(CO)=3:1的变化曲线为______ (填“曲线a"或“曲线b”)。
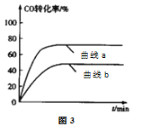
(3)某同学将H2、CO2的混合气体充入一个密闭容器中,控制其他条件不变,改变起始物中H2、CO2的物质的量之比(用n表示)进行反应2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g)△H=QkJ/mol,实验结果如图4所示(图中T表示温度):
CH3CH2OH(g)+3H2O(g)△H=QkJ/mol,实验结果如图4所示(图中T表示温度):
①若图像中T1>T2,则Q______0
②比较a、b、c三点所处的平衡状态中,反应物CO2的转化率最高的是____________,n=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
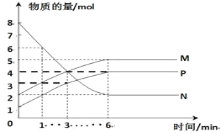
(1)反应化学方程式中各物质的系数比为a:b:c=______。
(2)1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_____。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗amolN,同时消耗bmolM
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是

A.1mol该烃完全燃烧消耗O2 11molB.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br2 3molD.分子中一定共平面的碳原子有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃A只可能有三种一氯取代物B、C和D,C的结构简式是如图:  ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下所示。
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下所示。
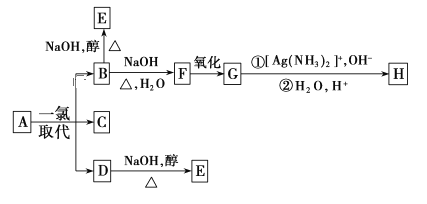
请回答下列问题:
(1)A的结构简式是_________。
(2)H的结构简式是________。
(3)B转化为F的反应属于____反应(填反应类型名称)。
(4)B转化为E的反应属于_____反应(填反应类型名称)。
(5)写出下列物质间转化的化学方程式①B→F:________,②F→G:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(1) 腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
(2) 环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com