
【题目】图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(1) 腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
(2) 环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标况)。
【答案】(1)c;
(2)2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)0.448。
【解析】
试题分析:(1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)n[Cu2(OH)3Cl]=![]() =0.02mol,根据转移电子得n(O2)=
=0.02mol,根据转移电子得n(O2)=![]() =0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448。
=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为 1L 的恒温密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示:
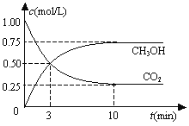
(1)达到平衡的时刻是_________min(填“3”或“10”)。在前10min内,用CO2浓度的变化表示的反应速率υ(CO2)=_________mol/(L· min)。
(2)能判断该反应达到化学平衡状态的依据是_________。
a.容器内压强不变 b.混合气体中c(CO2)不变 c.υ(CH3OH)=υ(H2O) d.c(CH3OH)=c(H2O)
(3)达平衡后,H2的转化率是_________。平衡常数 K =_________(计算结果保留一位小数)。为了提高H2的转化率,可采取_________(填“增大”或“减小”)CO2浓度的措施。
(4)工业上也可用 CO 和H2合成甲醇
已知:①CO(g) + ![]() O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + ![]() O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + ![]() O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
则反应CO(g) + 2H2(g) = CH3OH(g)△H=_________kJ/mol
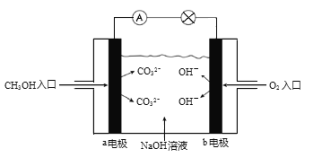
(5)如图是甲醇燃料电池原理示意图,电池正极的电极反应式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月3日我国确诊首例非洲猪瘟疫情。目前某有效药物的主要成分——姜黄素(分子式为C12H20O6)的一种合成路线如图所示:
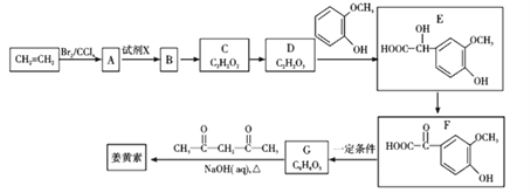
已知:
①![]()
![]() CH3CHO+CO2↑
CH3CHO+CO2↑
②CH3CHO+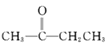
![]()
![]() +H2O
+H2O
回答下列问题:
(1)A的名称为_________;试剂X为_________。
(2)D中含有的官能团名称为_________。
(3)反应D→E的化学方程式为______________________________,其反应类型是________。
(4)下列有关G(C8H8O3)的叙述不正确的是_________(填正确答案编号)。
a.能与NaHCO3溶液反应 b.能与浓溴水发生取代反应
c.能与FeCl3溶液发生显色反应 d.l mol G最多能与3 mol H2发生加成反应
(5)姜黄素的结构简式为_________。
(6)G(C8H8O3)的同分异构体中,写出同时符合下列条件的结构简式为_________。
①苯环上的一取代物只有2种;
②核磁共振氢谱中有4组吸收峰;
③l mol该物质与烧碱溶液反应,最多消耗3 mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )

①铜电极的质量减少②正极反应为Ag++e-=Ag ③在外电路中,电流由铜电极流向银电极 ④实验过程中取出盐桥,原电池仍继续工作
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
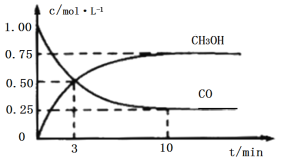
A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO)=0.075mol/(L·min1)
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是

A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com