
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
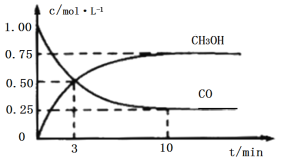
A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO)=0.075mol/(L·min1)
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
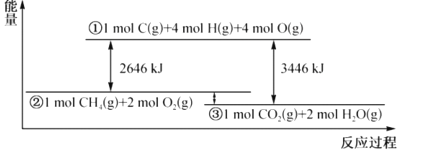
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-800kJmol-1
C.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量415kJ
D.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,有1molO-H键生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH 和 C2H518OH
B. 乙醛和丙烯醛不是同系物,它们与H2 充分反应后的产物是同系物
C. 甲苯能使酸性高锰酸钾溶液褪色,体现了侧链对苯环的影响
D. 乳酸薄荷醇酯(![]() )能发生水解反应、氧化反应、消去反应、取代反应
)能发生水解反应、氧化反应、消去反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均为短周期主族元素,且原子序数一次递增。A 是地壳中含量最多的元素, B 是短周期中金属性最强的元素,C 与 D 位置相邻,D 是同周期元素中原子半径最小的元素。完成下列填空:
(1)A 在周期表中的位置为第____周期______族,A 原子的最外层电子排布式为____,A 原子核外共有____个不同运动状态的电子。
(2)B、C、D 三种元素形成简单离子其半径大小的____________。(用个离子符号表示)
(3) A、B 形成化合物的电子式____;这些化合物中所含的化学键有____
(4)非金属性的强弱:C______D(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因。_____请用一个方程式证明 A 与 C 的非金属性的强弱____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:________________;不能肯定的是:_______________。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_________。(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)
(2)气体F的电子式为:_______________,实验中,可以观察到反应②的现象是:__________________。
(3)写出步骤①所有发生反应的离子方程式________________________、___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应: 2 A(g) + B(g) ![]() 3 C(g) + D(g)。试根据下图判断正确的是
3 C(g) + D(g)。试根据下图判断正确的是

A. 温度T1℃ 比 T2℃高
B. 正反应为放热反应
C. 甲图纵轴可以表示A的转化率
D. 甲图纵轴可以表示混合气体平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。

(1)②、⑥、⑧的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____ (用化学式表示)。
(3)As的原子结构示意图为_________其氢化物的化学式为__________;
(4)Y由②、⑥、⑧三种元索组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为__________,当消耗l mol还原剂时,电子转移了_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com