
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
分析 同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其氢化物的稳定性越强,据此分析解答.
解答 解:同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其氢化物的稳定性越强,
A.非金属性Cl>S>P>Si,所以氢化物的稳定性强弱顺序是HCl、H2S、PH3、SiH4,故A错误;
B.非金属性F>Cl>Br>I,所以氢化物的稳定性强弱顺序是HF、HCl、HBr、HI,故B正确;
C.非金属性F>Cl>S>Se,所以氢化物的稳定性HF>HCl>H2S>H2Se,故C错误;
D.非金属性F>N>P>As,所以氢化物的稳定性HF>NH3>PH3>AsH3,故D错误;
故选B.
点评 本题考查氢化物强弱顺序判断,为高频考点,明确非金属的非金属性与其氢化物的稳定性强弱关系是解本题关键,注意氢化物的稳定性与化学键有关,氢化物的熔沸点与分子间作用力有关,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
| 燃烧热/KJ•mol-1 | 1559.8 | 2219.9 | 2877.6 | 3535.6 |
| A. | 正庚烷在常温常压下肯定不是气体 | |
| B. | 烷烃燃烧热和其所含碳原子数成线性关系 | |
| C. | 随碳原子数增加,烷烃沸点逐渐升高 | |
| D. | 随碳原子数增加,烷烃沸点和燃烧热都成比例增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
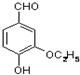 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.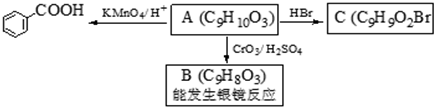
 .
. .
.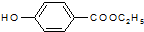 )是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).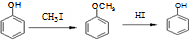
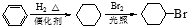
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
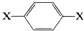 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )| A. | 该有机物燃烧时一定只生成CO2和H2O | |
| B. | 该有机物不可能为芳香醇 | |
| C. | 该有机物的分子式可能为C8H10O2 | |
| D. | 该有机物可能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成.都属于置换反应 | |
| B. | 氧化性KClO>Br,还原性Br->CI- | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中2mol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com