
分析 (1)为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、量筒、100mL容量瓶、胶头滴管、玻璃棒等;
(2)滴定终点时溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
(3)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中n(H2C2O4),进而计算100mL草酸溶液中n′(H2C2O4)和c(H2C2O4),计算草酸的质量,根据化学式质量分数计算求X的值.
解答 解:(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等,故还需要100mL容量瓶、胶头滴管、玻璃棒,
故答案为:100mL容量瓶、胶头滴管、玻璃棒;
(2)KMnO4溶液呈紫色,草酸反应完毕,当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
故答案为:当滴入最后一滴KMnO4溶液时,待测液刚好出现紫色且半分钟内不褪色;
(3)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,
n(KMnO4)=c mol•L-1×(b-a)×10-3L=c×(b-a)×10-3mol,
根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-3mol,
则100mL草酸溶液中n′(H2C2O4)=2.5×c×(b-a)×10-3mol×$\frac{100mL}{25mL}$=c×(b-a)×10-2mol,
所以c(H2C2O4)=$\frac{n}{V}$=$\frac{c×(b-a)×1{0}^{-2}mol}{0.1L}$=$\frac{1}{10}$c×(b-a)mol/L;
草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,
由化学式可知:$\frac{90}{90+18x}$=$\frac{c×(b-a)×1{0}^{-2}mol×90g/mol}{Wg}$,
解得x=$\frac{50W}{9c(b-a)}$-5,
故答案为:$\frac{1}{10}$c×(b-a)mol/L;$\frac{50W}{9c(b-a)}$-5.
点评 本题考查氧化还原滴定与计算,难度中等,注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法,侧重于考查学生的分析能力和计算能力.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | ${\;}_{17}^{35}$Cl- 与${\;}_{17}^{37}$Cl属同位素 | |
| C. | 单质气体分子中不一定都具有共价键 | |
| D. | CaCl2晶体中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.
欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
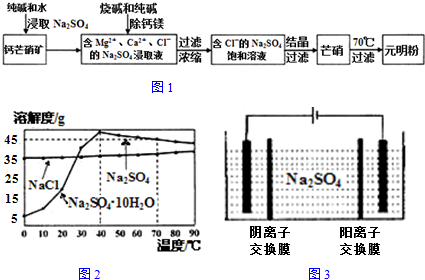
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
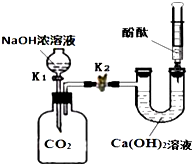 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com