
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是( )
A.“石碱”中含有离子键B.“石碱”中含有非极性共价键
C.“石碱”是离子化合物D.“石碱”中含有极性共价键
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Li3N是一种储氢材料,可以用Li和N2在450℃反应制备。已知Li3N易水解,细粉状的Li3N在空气中加热可发生剧烈燃烧。下图是某实验小组设计的实验室制备少量Li3N的装置图。请回答下列问题:
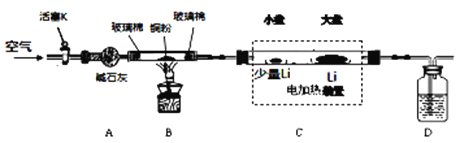
(1)B装置的作用是_________________,如果B装置中玻璃管两端没有玻璃棉可能造成的后果是____________________________。
(2)D装置中的试剂是_____________,作用是__________________________。
(3)C装置的小盘中放有少量Li的作用是____________________________。
(4)实验步骤如下:安装好仪器,检查装置气密性,装入药品;_________________________。(请按正确的顺序填入下列步骤的标号);拆除装置,取出产物。
①点燃B中酒精灯加热B中试管;
②打开活塞K;
③关闭电加热装置停,充分冷却;
④调节电加热装置控制温度为450℃;
⑤关闭活塞K;
⑥熄灭B中酒精灯;
(5)请你设计一个实验,用化学方法区分Li与Li3N,写出实验简要步骤及观察到的现象___________________________________。
(6)Li3N在H2中加热时可得到氨基锂(LiNH2),该反应在270℃可逆,所以Li3N可作为储氢材料,该反应的化学方程式为:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,△H>0,下列叙述正确的是( )
H++OH-,△H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw不变,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物M是一种香料,A与D是常见的有机化工原料,按下列路线合成化合物M:
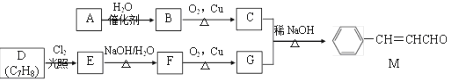
已知以下信息:
①A的相对分子质量为28

回答下列问题:
(1)A的名称是___________,A的结构简式___________。D的结构简式是___________。
(2)A生成B的反应类型为________,C中官能团名称为___________。
(3)E生成F的的化学方程式为___________。
(4)下列关于G的说法正确的是___________。(多选)
a.属于芳香烃
b.可与FeCl3溶液反应显紫色
c.可与新制的Cu(OH)2共热生成红色沉淀
d.G分子中最多有14个原子共平面
(5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有________种(不考虑立体异构)。
①与化合物M含有相同的官能团;②苯环上有两个取代基③醛基与双键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于卤素(F、Cl、Br、I)的性质的叙述,错误的是( )
A. 卤素单质的密度逐渐增大 B. 将氯水加到KI淀粉溶液中,溶液变蓝
C. 除了I2外,其它卤素单质都能将Fe氧化到+3价 D. F2能从NaCl溶液中置换出Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可以通过电解熔融AlCl3来冶炼铝
B. HF的稳定性很强,是因为其分子间能形成氢键
C. 非极性键不只存在于双原子单质分子中
D. 分解反应都是吸热反应,化合反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
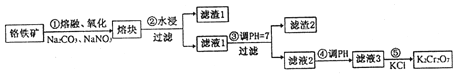
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
(2)滤渣1中含量最多的金属元素是_________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是______(用离子方程式表示)。
(4)某工厂用76 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16kg,则产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A.HNO3受热分解可生成NO2
B.Na在O2中燃烧可生成Na2O2
C.CaCl2暴露在空气中可生成CaCO3
D.向FeCl3溶液中滴加KSCN溶液,溶液显红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com