
【题目】下列说法正确的是( )
A. 可以通过电解熔融AlCl3来冶炼铝
B. HF的稳定性很强,是因为其分子间能形成氢键
C. 非极性键不只存在于双原子单质分子中
D. 分解反应都是吸热反应,化合反应都是放热反应
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】室温下,由水电离生成的c(H+)为1.0×10-12mol·L-1下列说法正确的是( )
A. 一定是酸溶液 B. 一定是碱溶液
C. 一定是显碱性的溶液 D. 可能是酸溶液,也可能是碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如图所示: 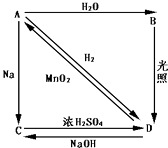
(1)分别写出下列物质的化学式:
BD
(2)试写出有关化学方程式:
A→B
D→A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是( )
A.“石碱”中含有离子键B.“石碱”中含有非极性共价键
C.“石碱”是离子化合物D.“石碱”中含有极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4( 硼氢化钠)广泛用于贮氢、有机合成及纳米材料制取等。回答下列问题:
(1)NaBH4的电子式为_________。
(2) NaBH4水解生成H2同时生成NaBO2,每生成1mol H2 转移电子数为______个;Kreevoy 等提出在碱性溶液中该水解反应的半衰期t1/2(反应物浓度减少一半所需时间) 与温度的关系式为l gt1/2=pH-(0.034T-1.92),其他条件相同时,贮氢时为减慢水解速率,应控制pH 及T的条件是______;已知0℃、pH=10时半衰期为4.32×102min,若此时NaBH4的依度为4.32 molL.1,则t0至半衰期生成H2的平均速率为_________molL-1min-1。
(3)直接NaBH4碱性燃料电池的结构如下图所示:
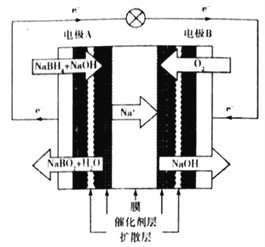
电池工作时,电极B周围溶液的pH______ (填“升高”“降低”或“不变”),电极A 上发生的电极反应式为_________________。
(4)制取NaBH4的方法之一是将Na2B4O7、SiO2 及金属Na按一定比例混合通H2 并加热到360- 370 ℃(同时生成Na2SiO3),该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水制取氯气、烧碱、溴及镁等工艺示意图如下:
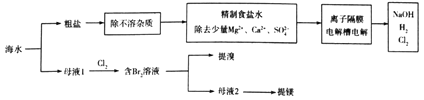
下列说法正确的是
A. “精制食盐水”时药品使用顺序为Na2CO3(aq)、NaOH(aq)、BaCl2(aq)及盐酸
B. 使用离子隔膜电解槽电解饱和食盐水时,其中的“隔膜”是“阳离子交换膜”
C. 工业上“母液1”氧化得到“含Br2溶液”后可直接用CCl4萃取,然后蒸馏得粗溴
D. “母液2”需经过加石灰乳生成沉定Mg(OH)2、过滤、盐酸溶解,然后直接电解得到镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2(g)+I2(g)2HI(g)已经达到平衡状态的标志是( )
①c(H2)=c(I2)=c(HI)
②c(H2):c(I2):c(HI)=1:1:2
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成n mol H2的同时生成n mol I2
⑥反应速率v(H2)=v(I2)= ![]() v(HI)
v(HI)
⑦一个H﹣H键断裂的同时有两个H﹣I键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
条件一定,混合气体的平均相对分子质量不再变化.
A.5项
B.4项
C.3项
D.2项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
3A(g)+B(g)2C(g)+D(g)
(1)达平衡时,a中A的浓度为M molL﹣1 , C的浓度为N molL﹣1 , b中A的浓度为m molL﹣1 , C的浓度为n molL﹣1 , 则Mm;Nn; (填“>”或“<”或“=”或“无法比较”)
(2)保持温度不变,按下列配比分别充入 a、b 两容器,达平衡后a中C的浓度为N molL﹣1的是 , b中C的浓度为n molL﹣1的是
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为WmolL﹣1 , C的浓度为YmolL﹣1 , 则W和M,Y和N之间的关系为WM、YN. (填>、<、=、无法比较)
(4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为R molL﹣1 , 则关系式正确的是
A.R=2M
B.R<M
C.M<R<2M
D.R>2M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法正确的是
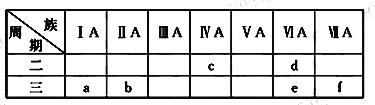
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. c、e、f的最高价氧化物对应的水化物的酸性依次增强
D. 六种元素中,c元素单质的化学性质最活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com