
【题目】室温下,由水电离生成的c(H+)为1.0×10-12mol·L-1下列说法正确的是( )
A. 一定是酸溶液 B. 一定是碱溶液
C. 一定是显碱性的溶液 D. 可能是酸溶液,也可能是碱溶液
科目:高中化学 来源: 题型:
【题目】钠和钠的化合物是重要的无机物。
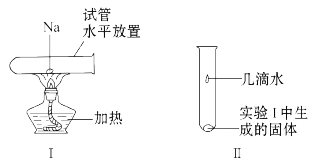
(1)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为____________,检验该反应产生的气体的方法是________________。
(2)铯与钠同主族,对于铯及其化合物性质的推断正确的是_________________________(填序号)。
①铯的熔点比钠的高 ②铯与氧气反应只生成Se2O ③SeOH的碱性比KOH强 ④铯不能从FeCl3溶液中置换出铁 ⑤SeCl的水溶液显中性
(3)某无色稀溶液中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH![]() 中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
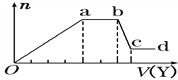
则X中一定含有的阳离子是______________________________,ab段反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用一下线路合成有机化合物M:
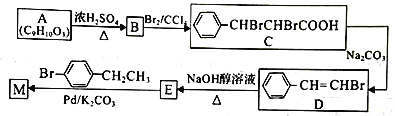
已知: R-C=CH+R'-Br![]() R-C
R-C![]() C- R'+HBr
C- R'+HBr
(1)B 中官能团的名称是____________,E的化学名称是_________________。
(2)M 的结构简式为____________________,由D生成E的反应类型是____________。
(3)写出C 与足量NaOH 溶液在加热条件下反应的化学方程式:___________________________。
(4)2 分子A在一定条件下反应生成一种含有3 个六元环的化合物,该生成物的结构简式为_________________________。
(5)同时满足下列条件的A 的同分异构体有____________种(不考虑立体异构)。
①属于芳香族化合物;
②能与碳酸氢钠溶液反应生成CO2
③在一定条件下能发生催化氧化,且其产物能发生银镜反应。
(6)以乙烯为起始原料,选用必要的无机试剂可以合成3一己炔,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li3N是一种储氢材料,可以用Li和N2在450℃反应制备。已知Li3N易水解,细粉状的Li3N在空气中加热可发生剧烈燃烧。下图是某实验小组设计的实验室制备少量Li3N的装置图。请回答下列问题:
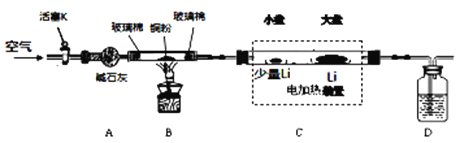
(1)B装置的作用是_________________,如果B装置中玻璃管两端没有玻璃棉可能造成的后果是____________________________。
(2)D装置中的试剂是_____________,作用是__________________________。
(3)C装置的小盘中放有少量Li的作用是____________________________。
(4)实验步骤如下:安装好仪器,检查装置气密性,装入药品;_________________________。(请按正确的顺序填入下列步骤的标号);拆除装置,取出产物。
①点燃B中酒精灯加热B中试管;
②打开活塞K;
③关闭电加热装置停,充分冷却;
④调节电加热装置控制温度为450℃;
⑤关闭活塞K;
⑥熄灭B中酒精灯;
(5)请你设计一个实验,用化学方法区分Li与Li3N,写出实验简要步骤及观察到的现象___________________________________。
(6)Li3N在H2中加热时可得到氨基锂(LiNH2),该反应在270℃可逆,所以Li3N可作为储氢材料,该反应的化学方程式为:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
A. 右图表示反应①中的能量变化

B. 可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
请回答下列问题: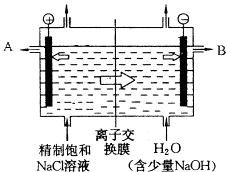
(1)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的通过(填写下列微粒的编号).
①H2 , ②Cl2 , ③Cl﹣ , ④H+ , ⑤Na+ , ⑥OH﹣ .
(2)B极为电解槽的极,电极反应式为 .
(3)若用碱性氢氧燃料电池给予上述电解槽供电,燃料电池的正极反应式为:; 如果每小时能产生标准状况下的氯气V L,则每小时至少向燃料电池中输入氧气的物质的量(理论计算)mol.
(4)若将标准状况下13.44L的阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,得到了两种含氯化合物,其中还原产物与氧化产物物质的量之比为5:1,写出该反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面。高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,在198℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④B.①③④⑥C.②③④⑤D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,△H>0,下列叙述正确的是( )
H++OH-,△H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw不变,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可以通过电解熔融AlCl3来冶炼铝
B. HF的稳定性很强,是因为其分子间能形成氢键
C. 非极性键不只存在于双原子单质分子中
D. 分解反应都是吸热反应,化合反应都是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com