
����Ŀ��������LiCO3��K2CO3Ϊ����ʣ���Ȼ���������������ṩ��Ӧ����ȼ�ϵ����ͼ������˵����ȷ���ǣ� ��
A.�Դ˵��Ϊ��Դ����ͭ������0.1mole��ת��ʱ����3.2gͭ�ܽ�
B.���Լ���Ϊȼ����ʱ������Ӧʽ��CH4+5O2����8e��=CO32��+2H2O
C.�õ��ʹ�ù������貹��Li2CO3��K2CO3
D.�����������缫��ӦʽΪ��O 2+4e��+2CO2=2CO32��
���𰸡�D
���������⣺A����⾫��ͭ��������ͭ���ӵõ���������ͭ���缫��ӦCu2++2e��=Cu������·��0.1mol e��ת�Ʒ�Ӧ����ͭ0.05mol�����ȫ����ͭ�ŵ磬���ܽ��ͭ������=0.05mol��64g/mol=3.2g����ͭ�б�ͭ�����õĽ������ȷŵ磬�����ܽ��ͭС��3.2g����A����
B������ͼʾ��Ϣ��ͨ�����ĵ缫�Ǹ������ڸ����ϣ������Ϊ��������������ʧ���ӵ�������Ӧ����H2��2e��+CO32��=CO2+H2O����B����
C������ת��4mol�ĵ��ӣ����ݵ缫��Ӧ�������缫��ӦʽΪ��H2��2e��+CO32��=CO2+H2O��ͨ�������CO2�Ļ������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪO2+4e��+2CO2=2CO32�� �� ��������2mol��̼������ӣ���������2mol��̼������ӣ�����̼������ӵ�Ũ�Ȳ��䣬��C����
D��ԭ��������ϵĵ缫��ӦʽΪO2+4e��+2CO2=2CO32�� �� ��D��ȷ��
��ѡ��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ����ȼ�ϵ��ԭ��ʾ��ͼ�����մ�ͼ����ʾ���ش��������⣺ 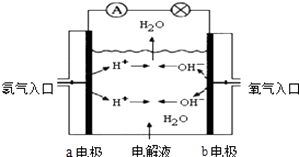
��1��������������ȷ���� A a�缫�Ǹ���
B b�缫�ĵ缫��ӦΪ��4OH����4e��=2H2O+O2��
C ����ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
D ����ȼ�ϵ����һ�ֲ���Ҫ����ԭ����������ȫ�������ڵ���ڵ����ͷ���װ��
��2�����������ҺΪKOH��Һ����缫��ӦʽΪ��a��b��
��3�����������ҺΪϡH2SO4 �� ��缫��ӦʽΪ��a��b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10%�İ�ˮ������ȷ�����ǣ� ��
A. 100g��ˮ�к�10gNH3H2O B. 100g��ˮ�к�10gNH3
C. 10gNH3����ˮ�γ�100g��Һ D. 10gNH3����100gH2O�γɵ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ��������������ṹB. ʯ�͵Ĵ��ѻ���Ϊ����������͵IJ���������
C. ������Ӧ�����²�õ���֬������D. ������֬ˮ���IJ����ж��и���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����10mLAgNO3��Һ������0.1mol/L��NaCl��Һʱ����Һ��pAg���ż���NaCl��Һ���������λmL���仯��ͼ��ʵ�ߣ�����֪��pAg=��lg{c��Ag+��}��Ksp��AgCl��=1��10��12 �� ����ͼ���������н�����ȷ���ǣ� ������ʾ��Ksp��AgCl����Ksp��AgI���� 
A.ԭAgNO3��Һ�����ʵ���Ũ��Ϊ0.1 molL��1
B.ͼ��x�������Ϊ��100��6 ��
C.ͼ��x�����Ϊ��Һ��Ag+��������ȫ
D.��0.1 molL��1��NaCl����0.1 molL��1NaI��ͼ�����յ���Ϊ���߲���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH3BO3������Ӧ���ڲ���������ҵ������þ��2MgOB2O3H2O��SiO2������Fe3O4��CaCO3��Al2O3��Ϊԭ����������Ĺ���������ͼ�� 
��֪��i��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��5.2��9.7��12.4��
����H3BO3��20�桢40�桢60�桢100��ʱ���ܽ������Ϊ5.0g��8.7g��14.8g��40.2g��
��1��Ϊ�������þ��۵Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�������ٴ���������
��2��������Һ�������ԣ���H3BO3��Mg2+��SO42�� �� ������Fe3+��Fe2+��Ca2+��Al3+�����ʣ������ӡ�ʱ�����Һ�����μ�������H2O2��MgO��H2O2���������������ӷ���ʽ��ʾ����MgO��ȥ������������ ��
��3����֪H3BO3�������NaOH��Ӧ����Na[B��OH��4]����д��H3BO3����Һ�еĵ��뷽��ʽ ��
��4������ȡ�����á��ȹ��ˡ���Ŀ���� �� ĸҺ�е���Ҫ������ ��
��5���ⶨ���ò�Ʒ�Ĵ��ȣ�ȡa g���ᣬС�ļ���ʹ��ֽ���ȥˮ�֣��������Ȳ��ֽ⣩���ò�������b g�����Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO��g��+ 2H2��g��![]() CH3OH��g�� ��H1=��116 kJ��mol��1
CH3OH��g�� ��H1=��116 kJ��mol��1
��1����֪�� ![]() ��H2=��283 kJ��mol��1
��H2=��283 kJ��mol��1
![]() ��H3=��242 kJ��mol��1
��H3=��242 kJ��mol��1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽ��________________
��2�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230����250����270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ����ش�:

�������������¶��У�����Z��Ӧ���¶���________________
������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO��g��+2H2��g��![]() CH3OH��g����ƽ�ⳣ�� K=_________��
CH3OH��g����ƽ�ⳣ�� K=_________��
��3����ij�¶��£���һ������CO��H2Ͷ��10L���ܱ������У�5minʱ�ﵽƽ�⣬�����ʵ����ʵ�Ũ�� ��molL��1���仯���±���ʾ��
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
��5min��10minֻ�ı���ijһ���������ı��������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ�������������ܴ�����������ҺΪ��ɫ�����ǣ� ��
A.Na+? K+? OH��?? Cl��
B.Na+?? Cu2+?? SO ![]() ?? NO
?? NO ![]()
C.Mg2+? Na+ ?SO ![]() ? Cl��
? Cl��
D.Ba2+?? HCO ![]() ? NO
? NO ![]() ? K+
? K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1��2017��1��2�հ���������������������������������������к��д���PM2.5��PM10������β���ȵȣ���PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42�� | NO3�� | Cl�� |
Ũ��/molL��1 | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
���ݱ��������ж�PM2.5������pH= ��
��2����һ�������µ���Һ�У���ӦFeCl3+3KSCNFe��SCN��3+3KCl�ﵽƽ����������������������£���������KCl���壬��ʹƽ���ƶ����������������������
��3����ĭ���������������̼��������Һ��Ӧ����Ӧ�����ӷ���ʽ�� ��
��4�������£�һ�����PH=2�Ķ�Ԫ����H2R��Һ������PH=12��NaOH��Һ��ϣ��û����Һ�е���غ�Ĺ�ϵʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com