
【题目】反应N2(g)+3H2(g)2NH3(g)的能量变化如图所示,a、b均为正值,单位是kJ,下列说法正确的是
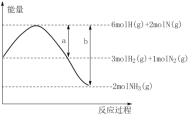
A.N2(g)+3H2(g)2NH3(g) △H=(a-b)kJ·mol-1
B.NH3(g)![]() N2(g)+
N2(g)+![]() H2(g) △H=(b-a)kJ·mol-1
H2(g) △H=(b-a)kJ·mol-1
C.NH3中氮氢键键能为bkJ·mol-1
D.压强越大,该反应的△H越小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
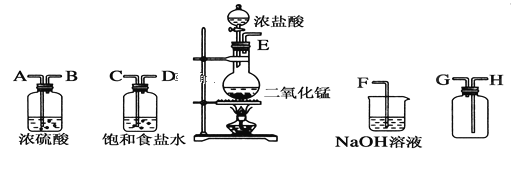
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)①气体发生装置中进行反应的化学方程式:_____________________________;该方程式中体现浓盐酸的__________________、____________________ 性质;氧化剂和还原剂的物质的量之比:________________________________________;
②NaOH溶液中发生反应的离子方程式:_______________________________________;
(4)实验室用下列方法制取氯气:①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,则反应后所得氯气的物质的量(_____)
A.①比②多 B.②比①多 C.两种方法一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10°C,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用同浓度的盐酸中和,消耗盐酸的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年。已知在元素周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。W与Q可以形成一种高温结构陶瓷材料,W的氯化物分子呈正四面体结构。回答下列问题:
(1)元素X在元素周期表中的位置_________
(2)W的氧化物的晶体类型是____________
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________
(4)这5个元素的氢化物分子中:
①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)_______
②电子总数相同的氢化物的化学式和立体结构分别是_________
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应O2(g)+2SO2(g)2SO3(g) ΔH<0,若在恒容绝热容器中发生,下列选项表明该反应一定已达平衡状态的是
A.容器内的密度不再变化
B.容器内的温度不再变化
C.容器内气体的反应速率υ正(O2)=2υ逆(SO2)
D.容器内气体的浓度c(O2)∶c(SO2)∶c(SO3)=1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下可利用甲烷消除氮氧化物的污染,例如:CH4+2NO2N2+CO2+2H2O。在2L密闭容器中,控制在不同温度下,分别加入0.50molCH4和0.90molNO2,测得n(CH4)随时间变化的有关实验数据如下表所示。
组别 | 温度 | n/mol | 时间/min | ||||
0 | 10 | 20 | 40 | 50 | |||
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法不正确的是
A.组别①中,0~20min内,NO2的降解速率为0.025mol·L-1·min-1
B.该反应的△H<0
C.40min时,x的数值应为0.15
D.0~20min内NO2的降解百分数①<②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
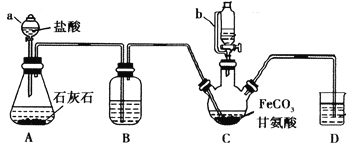
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法正确的是
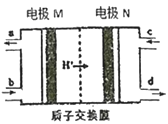
A. M极生成氮气且电极附近pH降低
B. 负极上每消耗1 mol N2H4,会有2 molH+通过质子交换膜
C. 正极的电极反应式为:O2+2H2O+4e-=4OH-
D. 电极M是原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com