
【题目】pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10°C,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用同浓度的盐酸中和,消耗盐酸的体积相同
【答案】A
【解析】
A.在氨水中存在一水合氨的电离平衡,NH3H2O![]() NH4++OH-,当向其中加入适量的氯化铵晶体,c(NH4+)增大,平衡逆向移动,c(OH-)减小,溶液的pH减小;当向NaOH溶液中加入氯化铵晶体后,发生反应:NaOH+NH4Cl=NaCl+NH3H2O,强碱变为弱碱,c(OH-)减小,溶液的pH减小,A正确;
NH4++OH-,当向其中加入适量的氯化铵晶体,c(NH4+)增大,平衡逆向移动,c(OH-)减小,溶液的pH减小;当向NaOH溶液中加入氯化铵晶体后,发生反应:NaOH+NH4Cl=NaCl+NH3H2O,强碱变为弱碱,c(OH-)减小,溶液的pH减小,A正确;
B.温度下降10°C,对一水合氨的电离平衡影响程度大于对水的影响,电离平衡逆向移动,c(OH-)减小,溶液的pH减小;对于NaOH溶液来说,NaOH电离产生的c(OH-)不变,但是水的电离平衡逆向移动,c(H+)减小,所以溶液的pH增大,B错误;
C.由于在氨水中存在弱碱的电离平衡,所以当分别加水稀释10倍,氨水中c(OH-)变化小,溶液的碱性强,因此氨水的pH大于NaOH溶液,C错误;
D.用同浓度的盐酸中和,由于氨水中电解质只有部分电离,其物质的量浓度大于NaOH溶液,所以碱的物质的量大于NaOH,故氨水消耗盐酸的体积大于NaOH,D错误。
故选A。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是___。
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。
①Na2CO3与NaHCO3质量均为1g时,消耗H+的物质的量更多的是___。
②以Na2CO3或NaHCO3为例,计算消耗H+的物质的量,写出计算过程。___
(3)小鲁实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。解释NaHCO3的作用___。
(4)某品牌复合膨松剂的说明书如图所示。

其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D 的原子序数依次增大,其中 C 为金属元素,A、C 的最外层电子数相等;C、D 两元素原子的质子数之和为 A、B 两元素质子数之和的 3 倍。
(1)写出 A、B、C、D 的元素符号:A_________,B_________,C_________,D_________ 。
(2)A、B、C、D 的原子半径大小顺序为 _________。
(3)A 和 C 形成化合物 CA 的电子式为_________。
(4) 用电子式表示C与D形成化合物 C2D 的 过 程 : _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表主族元素的一部分,短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
W | X | Y |
Z |
(1)Z的元素符号是________,原子结构示意图是_________。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为_________。
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 | ____ | ____ |
2 | ____ | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵常用作化肥和化工原料,工业上制备硝酸铵的简要流程如图:

(1)中和器中主要反应的化学方程式为___________
(2)制备硝酸铵采用加压中和法还是常压中和法?同时说明原因___________
(3)在不同的反应条件下,中和器中硝酸浓度与硝酸铵含量存在如图关系:
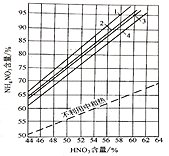
[不利用中和热及在不同情况下利用中和热时生产硝铵溶液中NH4NO3的含量1-HNO3和NH3(70℃);2-HNO3和NH3(50℃);3-HNO3(50℃)和NH3(20℃);4-HNO3和NH3(20℃)]
①按图中的数据分析,要使中和器中硝酸铵含量达到90%以上,原料最佳温度和硝酸最佳含量是__________
A. 70℃;58%
B. HNO3(50℃),NH3(20℃);56%
C. 50℃;56%
D. 20℃;58%
②中和器中产品检测时,工作人员发现N2浓度明显高于正常空气带入的N2浓度,试用化学方程式表示中和器中生成N2的最有可能的过程____________ 、___________
③以下制备硝酸铵分析不正确的是___________
A. 硝酸铵制备中应利用反应的中和热用于预热原料和浓缩硝酸铵溶液。
B. 采用真空蒸发器有利于获得较高浓度的硝酸铵溶液和较大颗粒的硝酸铵晶体析出。
C. 已知NH3与HNO3的气相反应很不彻底,工艺中应尽量使反应在液相中进行,可将硝酸持续匀速地通入预先装有液氨的中和器中反应。
D.充分回收、重复利用蒸发器的蒸气和冷凝液中的产品,可以降低原料损耗。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
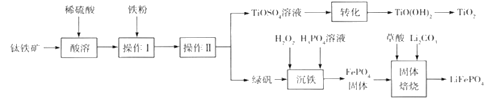
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
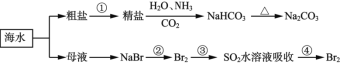
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)2NH3(g)的能量变化如图所示,a、b均为正值,单位是kJ,下列说法正确的是
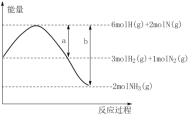
A.N2(g)+3H2(g)2NH3(g) △H=(a-b)kJ·mol-1
B.NH3(g)![]() N2(g)+
N2(g)+![]() H2(g) △H=(b-a)kJ·mol-1
H2(g) △H=(b-a)kJ·mol-1
C.NH3中氮氢键键能为bkJ·mol-1
D.压强越大,该反应的△H越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.使用催化剂的反应是吸热反应
C.在稀溶液中:H++OH﹣=H2O ΔH=﹣57.3 kJ·mol-1,若将含 1 molCH3COOH 的醋酸溶液与含 1 mol NaOH 的溶液混合,放出的热量小于 57.3 kJ
D.在 101 kPa 时,2 g H2 完全燃烧生成液态水,放出 285.8 kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)ΔH=+285.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com