
【题目】硝酸铵常用作化肥和化工原料,工业上制备硝酸铵的简要流程如图:

(1)中和器中主要反应的化学方程式为___________
(2)制备硝酸铵采用加压中和法还是常压中和法?同时说明原因___________
(3)在不同的反应条件下,中和器中硝酸浓度与硝酸铵含量存在如图关系:
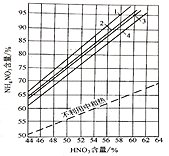
[不利用中和热及在不同情况下利用中和热时生产硝铵溶液中NH4NO3的含量1-HNO3和NH3(70℃);2-HNO3和NH3(50℃);3-HNO3(50℃)和NH3(20℃);4-HNO3和NH3(20℃)]
①按图中的数据分析,要使中和器中硝酸铵含量达到90%以上,原料最佳温度和硝酸最佳含量是__________
A. 70℃;58%
B. HNO3(50℃),NH3(20℃);56%
C. 50℃;56%
D. 20℃;58%
②中和器中产品检测时,工作人员发现N2浓度明显高于正常空气带入的N2浓度,试用化学方程式表示中和器中生成N2的最有可能的过程____________ 、___________
③以下制备硝酸铵分析不正确的是___________
A. 硝酸铵制备中应利用反应的中和热用于预热原料和浓缩硝酸铵溶液。
B. 采用真空蒸发器有利于获得较高浓度的硝酸铵溶液和较大颗粒的硝酸铵晶体析出。
C. 已知NH3与HNO3的气相反应很不彻底,工艺中应尽量使反应在液相中进行,可将硝酸持续匀速地通入预先装有液氨的中和器中反应。
D.充分回收、重复利用蒸发器的蒸气和冷凝液中的产品,可以降低原料损耗。
【答案】NH3+HNO3=NH4NO3 采用加压中和法。原因是加压可以增大反应的速率和提高产率 A 4HNO3=4NO2+O2+2H2O 6NO2+8NH3=7N2+12H2O BC
【解析】
(1)氨气属于碱性气体、硝酸具有酸性,所以碱性气体氨气和硝酸反应生成硝酸铵;
(2)压强越大化学反应速率越快,且增大压强可以提高产率;
(3)①要使中和器中硝酸铵含量达到90%以上,硝酸的含量越低越好;
②HNO3易分解生成NO2、O2、H2O,NO2、NH3能发生氧化还原反应生成N2。
(1)氨气属于碱性气体、硝酸具有酸性,所以碱性气体氨气和硝酸反应生成硝酸铵,反应方程式为NH3+HNO3=NH4NO3;
(2)压强越大单位体积内活化分子个数越多,则化学反应速率越快,该反应前后气体计量数减小,则增大压强可以提高产率,所以采用加压中和法;
(3)①要使中和器中硝酸铵含量达到90%以上,硝酸的含量越低越好,根据图知,温度为70℃、硝酸含量为58%最好,答案选A;
②HNO3易分解生成NO2、O2、H2O,NO2、NH3能发生氧化还原反应生成N2,发生的反应为4HNO3=4NO2+O2+2H2O、6NO2+8NH3=7N2+12H2O;
③A、中和时放出的热量预热原料能加快化学反应速率,浓缩溶液需要加热,所以硝酸铵制备中应利用反应的中和热用于预热原料和浓缩硝酸铵溶液,从而减少资源浪费,A正确,不符合题意;
B、结晶速率越慢得到的颗粒越大,采用真空蒸发器增大蒸发速率,虽然有利于获得较高浓度的硝酸铵溶液,但得到较小颗粒的硝酸铵晶体析出,B错误,符合题意;
C、将硝酸持续匀速地通入预先装有液氨的中和器中反应,放出的热量会使得液氨气化,会导致氨的转化率降低,不利于硝酸铵的制取,C错误,符合题意;
D、充分回收、重复利用蒸发器的蒸气和冷凝液中的产品,增大原料的利用,从而可以降低原料损耗,D正确,不符合题意;答案为:BC。


科目:高中化学 来源: 题型:
【题目】铝热反应在工业上有广泛应用:2Al+Fe2O3 高温 2Fe+Al2O3
(1)在该反应中,Al作_______(氧化剂或还原剂);
(2)该反应中被氧化的元素是__;
(3)在上述反应方程式上标出电子转移的方向和数目。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
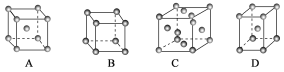
【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
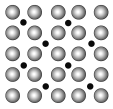
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
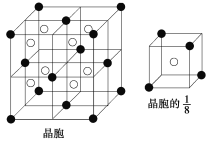
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①符合通式CnH2n+2 的烃一定都是烷烃,分子中均只含单键
②苯能使溴水褪色,说明苯环结构中含有碳碳双键
③乙酸与油酸(C17H33COOH)一定不是同系物
④乙烯能使溴水和酸性KMnO4 溶液褪色,且反应类型相同
⑤![]() 与
与![]() 是同分异构体
是同分异构体
⑥相同质量的烃完全燃烧,耗氧量最大的是 CH4
⑦戊二酸的分子式是C5H8O4,符合此分子式的二元酸有 3 种
A.①③⑦B.①③⑥C.②⑥⑦D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
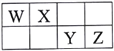
A. 原子半径大小:Z>Y>X
B. 最高价氧化物对应水化物的酸性:W>Y>Z
C. Y单质具有杀菌能力,Y与W可形成化合物WY2
D. W元素和氢元素形成的化合物可与Z单质反应,但不能与Z的氢化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10°C,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用同浓度的盐酸中和,消耗盐酸的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷铜制电路板的蚀刻液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的蚀刻液。
①蚀刻过程屮的离子方程式为______________________________。
②蚀刻结束后,可以通过两步先分离出铜,冉实现FcCl3溶液再生。
i.第1步所加试剂和操作分别为____________________________。
ii.第2步转化可加入的物质是_________________________(填一种即可)。
(2)H2O2也常用来做铜制电路板蚀刻液,使用时加入盐酸或氨水将其配制成酸性或碱性蚀刻液。应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:

①蚀刻铜板主要反应的离子方程式为_______________________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 C.NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程屮需控制反应的温度,当温度髙于80℃时,产品颜色发暗,其原因可能是______________________。
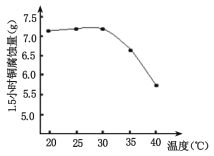
④如图是研究碱性蚀刻液的温度对锏腐蚀量的实验结果,升高温度,腐蚀量变化的原因______________________。
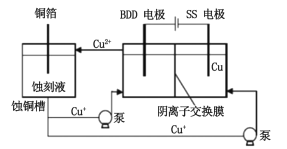
(3)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氡氧自由基(HO·),请写出BDD电极上的电极反应__________________,进一步溶液中反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应O2(g)+2SO2(g)2SO3(g) ΔH<0,若在恒容绝热容器中发生,下列选项表明该反应一定已达平衡状态的是
A.容器内的密度不再变化
B.容器内的温度不再变化
C.容器内气体的反应速率υ正(O2)=2υ逆(SO2)
D.容器内气体的浓度c(O2)∶c(SO2)∶c(SO3)=1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com