
ЎҫМвДҝЎҝПВБРЛө·Ё»тұнКҫ·ЁХэИ·өДКЗЈЁ Ј©
A.өИБҝөДБтХфЖшәНБт№ММе·ЦұрНкИ«ИјЙХЈ¬әуХЯ·ЕіцөДИИБҝ¶а
B.К№УГҙЯ»ҜјБөД·ҙУҰКЗОьИИ·ҙУҰ
C.ФЪПЎИЬТәЦРЈәHЈ«+OH©Ғ=H2O ҰӨH=©Ғ57.3 kJЎӨmol-1Ј¬ИфҪ«ә¬ 1 molCH3COOH өДҙЧЛбИЬТәУлә¬ 1 mol NaOH өДИЬТә»мәПЈ¬·ЕіцөДИИБҝРЎУЪ 57.3 kJ
D.ФЪ 101 kPa КұЈ¬2 g H2 НкИ«ИјЙХЙъіЙТәМ¬Л®Ј¬·Еіц 285.8 kJ ИИБҝЈ¬ЗвЖшИјЙХөДИИ»ҜС§·ҪіМКҪұнКҫОӘ 2H2ЈЁgЈ©+O2ЈЁgЈ©=2H2OЈЁlЈ©ҰӨH=+285.8 kJЎӨmol-1
Ўҫҙр°ёЎҝC
ЎҫҪвОцЎҝ
AЈ®№ММеЖш»ҜКұТӘОьИИЈ¬өИБҝөДБтХфЖшәНБт№ММе·ЦұрНкИ«ИјЙХЈ¬З°ХЯ·ЕіцөДИИБҝ¶аЈ¬№КAҙнОуЈ»
BЈ®ҙЯ»ҜјБКЗ·ҙУҰөДМхјюЈ¬ёДұд·ҙУҰөД»о»ҜДЬЈ¬·ҙУҰКЗОьИИ·ҙУҰ»№КЗ·ЕИИ·ҙУҰУлҙЯ»ҜјБОЮұШИ»БӘПөЈ¬№КBҙнОуЈ»
CЈ®CH3COOHКЗИхөзҪвЦКЈ¬өзАлКұТӘОьИИЈ¬ФЪПЎИЬТәЦРЈәHЈ«+OH©Ғ=H2O ҰӨH=©Ғ57.3 kJЎӨmol-1Ј¬ИфҪ«ә¬ 1 molCH3COOH өДҙЧЛбИЬТәУлә¬ 1 mol NaOH өДИЬТә»мәПЈ¬·ЕіцөДИИБҝРЎУЪ 57.3 kJЈ¬№КCХэИ·Ј»
DЈ®ФЪ 101 kPa КұЈ¬2 g H2 НкИ«ИјЙХЙъіЙТәМ¬Л®Ј¬·Еіц 285.8 kJ ИИБҝЈ¬ЗвЖшИјЙХөДИИ»ҜС§·ҪіМКҪұнКҫОӘ H2ЈЁgЈ©+![]() O2ЈЁgЈ©=H2OЈЁlЈ©ҰӨH=-285.8 kJЎӨmol-1Ј¬№КDҙнОуЈ»
O2ЈЁgЈ©=H2OЈЁlЈ©ҰӨH=-285.8 kJЎӨmol-1Ј¬№КDҙнОуЈ»
№КСЎCЎЈ


 »оБҰҝОКұН¬ІҪБ·П°ІбПөБРҙр°ё
»оБҰҝОКұН¬ІҪБ·П°ІбПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝpHПаН¬ЎўМе»эПаН¬өД°ұЛ®әНЗвСх»ҜДЖИЬТә·ЦұрІЙИЎПВБРҙлК©Ј¬УР№ШРрКцХэИ·өДКЗ
A.јУИлККБҝөДВИ»Ҝп§ҫ§МеәуЈ¬БҪИЬТәөДpHҫщјоРЎ
B.ОВ¶ИПВҪө10ЎгCЈ¬БҪИЬТәөДpHҫщІ»ұд
C.·ЦұрјУЛ®ПЎКН10ұ¶Ј¬БҪИЬТәөДpHИФПаөИ
D.УГН¬ЕЁ¶ИөДСОЛбЦРәНЈ¬ПыәДСОЛбөДМе»эПаН¬
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
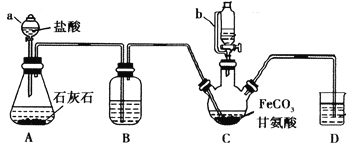
ЎҫМвДҝЎҝёК°ұЛбСЗМъ[(NH2CH2COO)2Fe]КЗТ»ЦЦІ№МъЗҝ»ҜјБЎЈДіС§П°РЎЧйАыУГFeCO3УлёК°ұЛб(NH2CH2COOH)ЦЖұёёК°ұЛбСЗМъЈ¬КөСйЧ°ЦГИзПВНјЛщКҫ(јРіЦәНјУИИТЗЖчТСКЎВФ)ЎЈ
УР№ШОпЦКРФЦКИзПВұнЈә
ёК°ұЛб | ДыГКЛб | ёК°ұЛбСЗМъ |
ТЧИЬУЪЛ®Ј¬ОўИЬУЪТТҙј | ТЧИЬУЪЛ®әНТТҙј | ТЧИЬУЪЛ®Ј¬ДСИЬУЪТТҙј |
БҪРФ»ҜәПОп | ЗҝЛбРФЎўЗҝ»№ФӯРФ |
КөСй№эіМЈә
IЈ®әПіЙЈәЧ°ЦГCЦРКўУР0.1mol FeCO3әН200mL1.0molЎӨL-1ёК°ұЛбИЬТәәНККБҝДыГКЛбЎЈКөСйКұЈ¬ПИҙтҝӘТЗЖчaөД»оИыЈ¬ҙэЧ°ЦГcЦРҝХЖшЕЕҫ»әуЈ¬јУИИІўІ»¶ПҪБ°иЈ¬ІўНЁ№эТЗЖчbПтCЦРјУИлККБҝЗвСх»ҜДЖИЬТәөчҪЪpЈИөҪ6ЧуУТЈ¬К№·ҙУҰОпід·Ц·ҙУҰЎЈ
ўтЈ®·ЦАлЈә·ҙУҰҪбКшә󣬹эВЛЈ¬Ҫ«ВЛТәҪшРРХф·ўЕЁЛхЈ»јУИлОЮЛ®ТТҙјЈ¬№эВЛЎўПҙөУІўёЙФпЎЈ
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ТЗЖчaөДГыіЖКЗ________Ј»УлaПаұИЈ¬ТЗЖчbөДУЕөгКЗ_____________________________ЎЈ
ЈЁ2Ј©Ч°ЦГBЦРКўУРөДКФјБКЗ____________Ј»КөСй№эіМЦРЧ°ЦГDөДөј№ЬТ»ЦұГ»ИлТәГжПВөДұШТӘРФКЗ___________________________________________ЎЈ
ЈЁ3Ј©әПіЙ№эіМјУИлДыГКЛбөДЧчУГКЗҙЩҪшFeCO3ИЬҪвәН________________________ ЎЈ
ЈЁ4Ј©јУИлЗвСх»ҜДЖИЬТәөчҪЪpHИфҙуУЪ6Ј¬ёК°ұЛбСЗМъІъБҝПВҪөЎЈФӯТтҝЙУГАлЧУ·ҪіМКҪұнКҫОӘ________ЎЈ
ЈЁ5Ј©№эіМIIЦРјУИлОЮЛ®ТТҙјөДДҝөДКЗ_______________________ЎЈ
ЈЁ6Ј©јмСйІъЖ·ЦРКЗ·сә¬УРFe3+өДКФјБГыіЖКЗ_________ ЎЈ
ЈЁ7Ј©ұҫКөСйЦЖөГ15.3gёК°ұЛбСЗМъЈЁM=204g/molЈ©Ј¬ФтЖдІъВККЗ_____ЈҘЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИјБПөзіШЧчОӘ°ІИ«РФДЬҪПәГөДТ»Аа»ҜС§өзФҙөГөҪБЛёьҝмөД·ўХ№Ј¬Т»ЦЦТФБӘ°ұЈЁN2H4Ј©ОӘИјБПөД»·ұЈөзіШ№ӨЧчФӯАнИзНјЛщКҫЈ¬№ӨЧчКұІъЙъОИ¶ЁОЮОЫИҫөДОпЦКЎЈПВБРЛө·ЁХэИ·өДКЗ
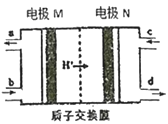
A. Mј«ЙъіЙөӘЖшЗТөзј«ёҪҪьpHҪөөН
B. ёәј«ЙПГҝПыәД1 mol N2H4Ј¬»бУР2 molH+НЁ№эЦКЧУҪ»»»ДӨ
C. Хэј«өДөзј«·ҙУҰКҪОӘЈәO2+2H2O+4e-=4OH-
D. өзј«MКЗФӯөзіШөДХэј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪТ»¶ЁМхјюПВЈ¬ТСҙпЖҪәвөДҝЙДж·ҙУҰЈә2A(g)Ј«B(g)![]() 2C(g)Ј¬ПВБРЛө·ЁЦРХэИ·өДКЗ ЈЁ Ј©
2C(g)Ј¬ПВБРЛө·ЁЦРХэИ·өДКЗ ЈЁ Ј©
A. ЖҪәвКұЈ¬ҙЛ·ҙУҰөДЖҪәвіЈКэKУлёчОпЦКөДЕЁ¶ИУРИзПВ№ШПөЈәKЈҪ![]()
B. ёДұдМхјюәуЈ¬ёГ·ҙУҰөДЖҪәвіЈКэKТ»¶ЁІ»ұд
C. Из№ыёДұдС№ЗҝІўјУИлҙЯ»ҜјБЈ¬ЖҪәвіЈКэ»бЛжЦ®ұд»Ҝ
D. ИфЖҪәвКұФцјУAәНBөДЕЁ¶ИЈ¬ФтЖҪәвіЈКэ»бјхРЎ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРУР№ШЛө·ЁХэИ·өДКЗЈЁ Ј©
A. КөСйКТЦЖЗвЖшЈ¬ОӘБЛјУҝм·ҙУҰЛЩВКЈ¬ҝЙПтПЎБтЛбЦРөОјУЙЩБҝПхЛбНӯИЬТә
B. ҝЙУГАХПДМШБРФӯАнҪвКН2NO2(g)![]() N2O4(g)МеПөјУС№әуСХЙ«ұдЙо
N2O4(g)МеПөјУС№әуСХЙ«ұдЙо
C. N2(g)+ 3H2(g)![]() 2NH3(g) ҰӨHЈј0ҝЙНЁ№эјУС№·ҪКҪФцҙуЖдЖҪәвіЈКэ
2NH3(g) ҰӨHЈј0ҝЙНЁ№эјУС№·ҪКҪФцҙуЖдЖҪәвіЈКэ
D. ¶юСх»ҜБтәНТТП©БҪЦЦЖшМе·ЦұрНЁИлBr2өДCCl4ИЬТәЈ¬ДЬК№ИЬТәНКЙ«өДКЗТТП©ЖшМе
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ°ў·ьјУөВВЮіЈКэөДЦөОӘ![]() ЎЈПВБРЛө·ЁХэИ·өДКЗ
ЎЈПВБРЛө·ЁХэИ·өДКЗ
A. 1L0.1molЎӨ![]() NH4ClИЬТәЦРЈ¬
NH4ClИЬТәЦРЈ¬ ![]() өДКэБҝОӘ0.1
өДКэБҝОӘ0.1![]()
B. 2.4gMgУлH2SO4НкИ«·ҙУҰЈ¬ЧӘТЖөДөзЧУКэОӘ0.1![]()
C. ұкЧјЧҙҝцПВЈ¬2.24LN2әНO2өД»мәПЖшМеЦР·ЦЧУКэОӘ0.2![]()
D. 0.1mol H2әН0.1mol I2УЪГЬұХИЭЖчЦРід·Ц·ҙУҰәуЈ¬Жд·ЦЧУЧЬКэОӘ0.2![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪ·ҙУҰ3BrF3Ј«5H2O===HBrO3Ј«Br2Ј«9HFЈ«O2ЎьЦРЈ¬ИфУР5 mol H2OЧчОӘ»№ФӯјБКұЈ¬ұ»»№ФӯөДBrF3өДОпЦКөДБҝОӘ(ЎЎЎЎ)
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝБтЛбөД№ӨТөЦЖұёКЗТ»ёцЦШТӘөД»Ҝ№ӨЙъІъ№эіМЈ¬ө«ФЪЙъІъ№эіМЦР»бІъЙъҙуБҝОЫИҫЈ¬РиТӘФЪЙъІъ№ӨТХЦРҝјВЗөҪВМЙ«№ӨТХЈ®ТФБтЛб№ӨТөІъЙъөД¶юСх»ҜБтОІЖшЎў°ұЛ®ЎўКҜ»ТКҜЎўҪ№МҝЎўМјЛбЗвп§ОӘФӯБПҝЙТФәПіЙБт»ҜёЖЎўБтЛбп§ЎўСЗБтЛбп§өИОпЦКЈ®әПіЙВ·ПЯИзПВЈә
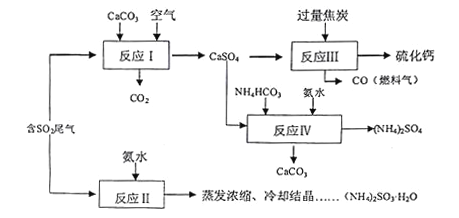
ЈЁ1Ј©Рҙіц·ҙУҰўсөД»ҜС§·ҪіМКҪ________________________Ј®
ЈЁ2Ј©·ҙУҰўуЦРГҝЙъіЙlmolБт»ҜёЖАнВЫЙПЧӘТЖөзЧУКэ________Ј»ОӘід·ЦАыУГёұІъЖ·COЈ¬УРИЛМбіцТФИЫИЪөДK2C03ОӘөзҪвЦКЈ¬ЙијЖИјБПөзіШЈ¬ЗлРҙіцҙЛөзіШөДёәј«·ҙУҰ_____________Ј®
ЈЁ3Ј©ОӘјмСй·ҙУҰўтөГөҪөДІъЖ·КЗ·сТтІҝ·Цұ»Сх»Ҝ¶шұдЦКЈ¬РиСЎФсөД»ҜС§КФјБУР__________________Ј®
ЈЁ4Ј©ёщҫЭәПіЙБчіМЈ¬ҝЙТФСӯ»·АыУГөДКЗ____________Ј®
ЈЁ5Ј©ЈЁNH4Ј©2SO3ИЬТәҝЙУГУЪөзі§ІъЙъөДСМөАЖшөДНСөӘЈ¬Ҫ«өӘСх»ҜОпЧӘ»ҜОӘөӘЖшЈ¬Н¬КұЙъіЙТ»ЦЦөӘ·КЈ¬РОіЙ№ІЙъПөНіЈ®Рҙіц¶юСх»ҜөӘУлСЗБтЛбп§·ҙУҰөДАлЧУ·ҪіМКҪ___________________Ј®
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com