
【题目】硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
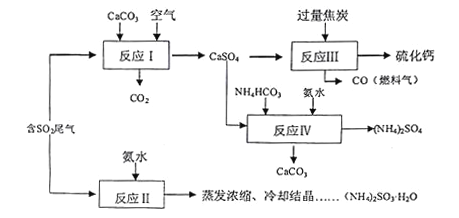
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
【答案】2CaCO3+O2+2SO2=2CaSO4+2CO2 8NA CO+CO32﹣﹣2e﹣=2CO2 稀盐酸、BaCl2溶液 CaCO3 2NO2+4SO32﹣=N2+4SO42﹣
【解析】
本题是化学工艺流程题。以工业上处理二氧化硫的工艺(钙基固硫和氨水吸收)为主线生产相关产品,变废为宝。
(1). 钙基固硫的反应。因为亚硫酸酸性比碳酸强,所以将向碳酸钙浆液中通入二氧化硫可以生成亚硫酸钙和二氧化碳,亚硫酸钙再被氧气氧化为硫酸钙,总反应为:2CaCO3+O2+2SO2=2CaSO4+2CO2
(2). 反应Ⅲ的化学方程式为:CaSO4+4C = CaS+4CO↑,反应中硫的化合价从+6降到-2,共转移8个电子,所以每生成1molCaS理论上要转移的电子数为 8NA 。
(3). 根据CO的燃烧生成CO2,CO发发生了氧化反应,根据原电池原理,负极上还原剂发生氧化反应,由于电解质为熔融的碳酸钾,所以由提供氧原子与CO形成CO2分子,CO中C的化合价从+2升高到+4,要失去2个电子,所以电极反应式为:CO+CO32﹣﹣2e﹣=2CO2
(4). 反应Ⅱ得到的产品为亚硫酸铵易被空气中的氧气氧化生成硫酸铵,所以要检验产品是否变质可以检验硫酸根离子,实验室检验硫酸根离子的常用试剂为稀盐酸和BaCl2溶液
(5). 分析上述流程图可发现,反应I用到原料中有CaCO3 ,反应IV有副产品CaCO3生成,所以CaCO3可以循环利用。
(6). 二氧化氮有很强的氧化性,而亚硫酸根有很强的还原性,根据化合价通常邻位转化规律,二氧化氮可以将亚硫酸根氧化为硫酸根,所以离子方程式为:2NO2+4SO32﹣=N2+4SO42﹣


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.使用催化剂的反应是吸热反应
C.在稀溶液中:H++OH﹣=H2O ΔH=﹣57.3 kJ·mol-1,若将含 1 molCH3COOH 的醋酸溶液与含 1 mol NaOH 的溶液混合,放出的热量小于 57.3 kJ
D.在 101 kPa 时,2 g H2 完全燃烧生成液态水,放出 285.8 kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)ΔH=+285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116 g跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4 mol
C.参加反应的HCl的质量为146 g
D.被还原的MnO2的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
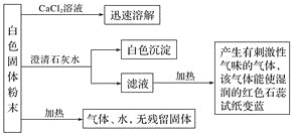
请回答下列问题:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去)。
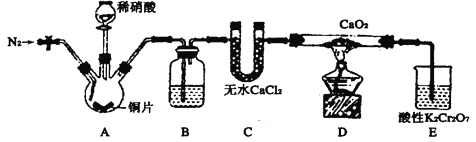
已知:2NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2。
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因为(用方程式表示)_________。
(2)装置B所加试剂是__________,作用是除去__________(填化学式)。
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成![]() ,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是__________。
,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是__________。
(4)已知:Ca(NO2)2溶液遇酸会产生NO气体。设计实验证明装置D中有亚硝酸钙生成:_________。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO+NO2=Ca(NO2)2+H2O。
①若n(NO) :n(NO2)>1 :1,则会导致_______________;
②若n(NO) :n(NO2)<1 :1,则会导致________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是( )

A.若a的相对分子质量是42,则d是乙醛
B.若d的相对分子质量是44,则a是乙炔
C.若a为苯乙烯(C6H5—CH=CH2),则f的分子式是C16H32O2
D.若a为单烯烃,则d与f的最简式一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是( )
A.装置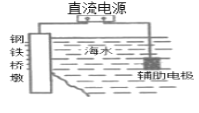 中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
B.装置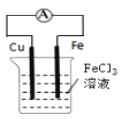 的总反应式:Cu+2Fe3+=Cu2++2Fe2+
的总反应式:Cu+2Fe3+=Cu2++2Fe2+
C.装置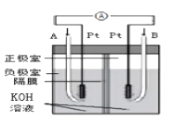 为氢氧燃料电池的工作原理,A中通入的气体是氧气
为氢氧燃料电池的工作原理,A中通入的气体是氧气
D.装置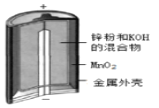 为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将符合反应类型的反应的序号填在下列分类方法后的横线上
A.4Fe3O4+O2![]() 6Fe2O3
6Fe2O3
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4=ZnSO4+H2↑
D.CaCO3+2HCl=CaCl2+H2O +CO2↑
E.CH4+2O2![]() CO2+2H2O
CO2+2H2O
F. 3O2![]() 2O3
2O3
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.H2SO4+2NaOH=Na2SO4+2H2O
①属于化合反应的是____(填字母,下同)
②属于分解反应的是____;
③属于复分解反应的是____;
④属于置换反应的是____;
⑤既不属于四种基本反应类型又不属于氧化还原反应的是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com