
【题目】某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
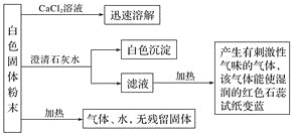
请回答下列问题:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________
【答案】CaCO3 NH3 NH4HCO3 NH4HCO3 ![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
【解析】
该白色固体加入CaCl2溶液,迅速溶解,溶液中无CO32-,加入澄清石灰水中有白色沉淀生成,说明白色固体中含有HCO3-,加热加入澄清石灰水后所得滤液,有刺激性气味的气体产生,且该气体能使湿润的红色石蕊试纸变蓝,说明白色固体粉末中有NH4+,故该白色固体是NH4HCO3。
(1)白色固体粉末加入CaCl2溶液,迅速溶解,溶液中无有CO32-,加入澄清石灰水中有白色沉淀生成,说明白色固体中含有HCO3-,白色沉淀为CaCO3,加热加入澄清石灰水后所得滤液,有刺激性气味的气体产生,且该气体能使湿润的红色石蕊试纸变蓝,故该气体是NH3;
(2)有白色固体中含有NH4+、HCO3-,故该白色固体粉末是NH4HCO3;
(3)该白色固体粉末受热分解即NH4HCO3受热分解,化学方程式为:NH4HCO3 ![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O


科目:高中化学 来源: 题型:
【题目】燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法正确的是
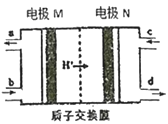
A. M极生成氮气且电极附近pH降低
B. 负极上每消耗1 mol N2H4,会有2 molH+通过质子交换膜
C. 正极的电极反应式为:O2+2H2O+4e-=4OH-
D. 电极M是原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中的反应物和生成物有 FeCl3、FeCl2、Cu、CuCl2。有人将上述反应设计成原电池并画图。
(1)该电池总反应的离子方程式为_____;
(2)画出原电池装置图_____;
(3)一段时间后负极质量减轻 m g,则下列说法正确的是_____(填写序 号)。(Cu:64、Fe:56)
A.电路中通过的电子为 ![]() mol
mol
B.正极质量增加 ![]() g
g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中 Cl-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入 1 mL 0.01 mol/L 酸 性 KMnO4 溶液,再加入 1 滴 3 mol/L 硫酸和 9 滴蒸馏水,最后加入 1 mL 0.1 mol/L草酸溶液 | 前 10 min 内溶液紫色无明显变化,后颜色逐渐变浅, 30 min 后几乎变为无色 |
II | 向另一支试管中先加入 1 mL 0.01 mol/L 酸性 KMnO4 溶液,再加入 10 滴 3 mol/L硫酸,最后加入 1 mL 0.1 mol/L 草酸溶液 | 80 s 内溶液紫色无明显变 化,后颜色迅速变浅,约 150 s 后几乎变为无色 |
(1)补全高锰酸钾与草酸反应的离子方程式:5H2C2O4 + 2MnO4- + 6H+ =2Mn2+ +_____+_____
(2)由实验 I、II 可得出的结论是_____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。
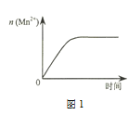
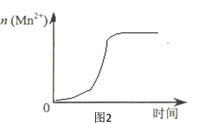
该小组同学根据图2所示信息关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想提出了新的猜想,并继续进行实验探究。
Ⅰ.该小组同学提出的猜想是_____。
Ⅱ.请你帮助该小组同学完成实验方案,并填写表中空白。
(实验内容及记录)(H2C2O4 溶液足量)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | ||
0.1 mol/L H2C2O4 溶液 | 0.01 mol/L KMnO4 溶液 | 3 mol/L 稀硫酸 | |||
1 | 1.0 | 1.0 | 10 滴 | 无 | 150S |
2 | 1.0 | 1.0 | 10 滴 | _____ | t |
Ⅲ.若该小组同学提出的猜想成立,则 t______“>”“<”“=”) 150S应观察到的现象是_____。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
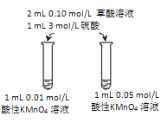
① 他们拟研究的影响因素是_____。
② 你认为他们的实验方案_____(填“合理”或“不合理”),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
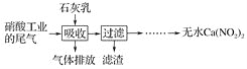
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
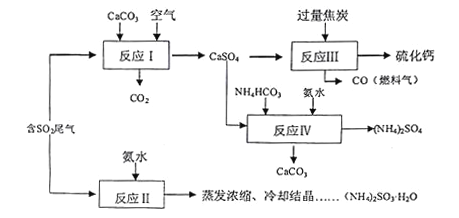
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学反应的描述正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO的燃烧热ΔH=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) ΔH=(2×283.0)kJ/mol
C.已知:C(s)+O2(g)=CO2(g)△H1;C(s)+![]() O2(g)=CO(g)△H2 ,则△H1>△H2
O2(g)=CO(g)△H2 ,则△H1>△H2
D.C(石墨,s)= C(金刚石,s) ΔH=+1.9kJ·mol-1 ,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com