
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
【答案】D
【解析】
A.H2O中心原子O原子成2个σ键、含有孤对电子数为![]() =2,则杂化轨道数为4,采取sp3杂化,价电子对互斥理论模型为正四面体,而分子的空间结构为V形,故A错误;
=2,则杂化轨道数为4,采取sp3杂化,价电子对互斥理论模型为正四面体,而分子的空间结构为V形,故A错误;
B.BBr3中心原子B原子成3个σ键、含有孤对电子数为![]() =0,则杂化轨道数为3,采取sp2杂化,价电子对互斥理论模型为平面三角形,而分子的空间结构为平面三角形,故B错误;
=0,则杂化轨道数为3,采取sp2杂化,价电子对互斥理论模型为平面三角形,而分子的空间结构为平面三角形,故B错误;
C.PCl3中心原子P原子成3个σ键、含有孤对电子数为![]() =1,则杂化轨道数为4,采取sp3杂化,价电子对互斥理论模型为正四面体,而分子的空间结构为三角锥形,故C错误;
=1,则杂化轨道数为4,采取sp3杂化,价电子对互斥理论模型为正四面体,而分子的空间结构为三角锥形,故C错误;
D.CO32-中心原子O原子成3个σ键、含有孤对电子数为![]() =0,则杂化轨道数为3,采取sp2杂化,价电子对互斥理论模型为平面三角形,而离子的空间结构为平面三角形,故D正确;
=0,则杂化轨道数为3,采取sp2杂化,价电子对互斥理论模型为平面三角形,而离子的空间结构为平面三角形,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
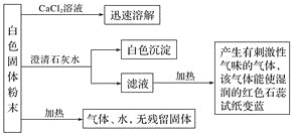
请回答下列问题:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是( )
A.装置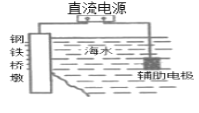 中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
B.装置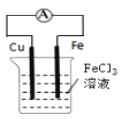 的总反应式:Cu+2Fe3+=Cu2++2Fe2+
的总反应式:Cu+2Fe3+=Cu2++2Fe2+
C.装置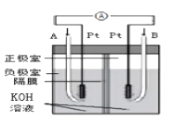 为氢氧燃料电池的工作原理,A中通入的气体是氧气
为氢氧燃料电池的工作原理,A中通入的气体是氧气
D.装置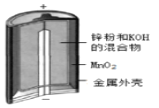 为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
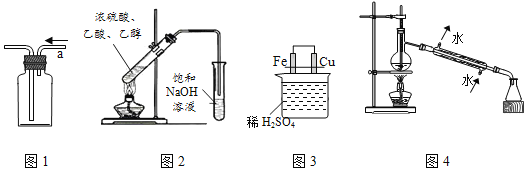
A. 用图1从a口进气可收集乙烯 B. 用图2制取并收集乙酸乙酯
C. 用图3比较Fe、Cu的金属活动性 D. 用图4进行石油的蒸馏实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机化合物相关的说法正确的是![]()
![]()
A.糖类、油脂、蛋白质都能水解,但水解产物不同
B.四苯基乙烯![]()
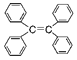
![]() 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C.![]() 在一定条件下与足量H2反应消耗4mol H2
在一定条件下与足量H2反应消耗4mol H2
D.分子式为C7H8的芳香烃与H2完全加成所得产物的一氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将符合反应类型的反应的序号填在下列分类方法后的横线上
A.4Fe3O4+O2![]() 6Fe2O3
6Fe2O3
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4=ZnSO4+H2↑
D.CaCO3+2HCl=CaCl2+H2O +CO2↑
E.CH4+2O2![]() CO2+2H2O
CO2+2H2O
F. 3O2![]() 2O3
2O3
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.H2SO4+2NaOH=Na2SO4+2H2O
①属于化合反应的是____(填字母,下同)
②属于分解反应的是____;
③属于复分解反应的是____;
④属于置换反应的是____;
⑤既不属于四种基本反应类型又不属于氧化还原反应的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO4-- 2e-=S2O82-+2H+。下列说法正确的是( )
A. 阴极电极反应式为Pb+HSO4-- 2e-=PbSO4+H+
B. 阳极反应中S的化合价升高
C. S2O82-中既存在非极性键又存在极性键
D. 可以用铜电极作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物粉末15g,与足量的盐酸反应生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
A.Mg、FeB.Zn、AgC. Fe、ZnD.Mg、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com