
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)基态K原子中,核外运动状态不同的电子共________种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K________(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为________,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为________
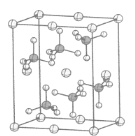
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。
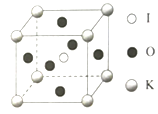
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为________nm,与K紧邻的O的个数为________。
【答案】19 球形 < < 三角锥形 sp3杂化 HIO4中的非羟基氧原子数目更多,使得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强 ![]() nm 或0.386 nm 12
nm 或0.386 nm 12
【解析】
(1)每个电子运动状态都不相同,4S能级的电子云轮廓图形状为球形;
(2)K和Cr属于同一周期,K的原子半径较大,较容易失去电子。K的原子半径较大,且价电子较少,金属键较弱;
(3)若中心原子A有孤电子对,根据中心原子价层电子对判断VSEPR模型,结合孤电子对判断空间构型;
(4)HIO4中I的正电性更高,导致I-O-H中O的电子向I偏移,更容易电离出H+,酸性更强;
(5)K与I间的最短距离为体对角线的一半。O位于面心,K位于顶点,1个顶点为12个面共有。
(1)基态K原子的核外电子排布式为1S22S22P63S23P64S1,总共19个电子,每个电子运动状态都不相同,则核外运动状态不同的电子共19种,占据最高能级为4S,电子云轮廓图形状为球形;
(2)K和Cr属于同一周期,K的原子半径较大,较容易失去电子,故第一电离能:K<Cr。K的原子半径较大,且价电子较少,金属键较弱,金属键强度:K<Cr;
(3)IO3-离子中心原子I原子价层电子对为![]() =4, VSEPR模型为四面体,由于含1对孤电子对,故空间构型是三角锥形,中心原子杂化方式是sp3杂化;
=4, VSEPR模型为四面体,由于含1对孤电子对,故空间构型是三角锥形,中心原子杂化方式是sp3杂化;
(4)HIO4的酸性强于HIO3,是因为HIO4中非羟基氧原子的数目更多,便得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强;
(5)K与I间的最短距离为体对角线的一半,则K与O间的最短距离为![]() a=
a=![]() 0.446nm
0.446nm![]() 。O位于面心,K位于顶点,1个面心的原子参与形成2个晶胞,1个顶点参与形成8个晶胞,每个晶胞中与K紧邻的O个数为3个,故在晶体中,与K紧邻的O数目是12个。
。O位于面心,K位于顶点,1个面心的原子参与形成2个晶胞,1个顶点参与形成8个晶胞,每个晶胞中与K紧邻的O个数为3个,故在晶体中,与K紧邻的O数目是12个。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】镁铁水滑石(镁、铁的碱式碳酸盐)是具有层状结构的无机功能材料,可由Mg(NO3)2·6H2O、Fe(NO3)3·9H2O及CO(NH2)2等按一定比例在温度高于90℃时反应制得。
(1)其他条件不变时,n[CO(NH2)2]/n(Fe3+)对镁铁水滑石产率和溶液pH的变化关系如图所示:
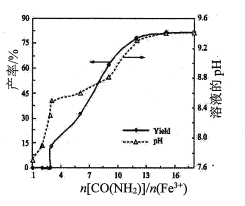
① <3,反应液中产生少量气体,测氨仪未检出NH3,说明逸出的气体主要是____________(填化学式)。
<3,反应液中产生少量气体,测氨仪未检出NH3,说明逸出的气体主要是____________(填化学式)。
②n[CO(NH2)2]/n(Fe3+)>12,溶液的pH处于稳定状态,这是因为_________________
(2)镁铁水滑石表示为:[FexMgy(OH)z](CO3)w·pH2O(摩尔质量为660g·mol-1),可通过下列实验和文献数据确定其化学式,步骤如下:
I.取镁铁水滑石3.300g加入足量稀硫酸充分反应,收集到气体112mL(标准状况)。
II.文献查得镁铁水滑石热分解TG-DSC图:303~473K,失去层间水(结晶水)失重为10.9%;473~773K时,CO32-和OH-分解为CO2和H2O;773K以上产物为MgO、Fe2O3。
Ⅲ.称取0.4000g热分解残渣(773K以上)置于碘量瓶中,加入稍过量盐酸使其完全溶解,加入适量水和稍过量的KI溶液,在暗处放置片刻,用0.1000mol·L-1Na2S2O3标准溶液滴定到溶液呈淡黄色,加入3mL淀粉溶液,继续滴定到溶液蓝色消失。(2Na2S2O3+I2=2NaI+Na2S4O6),消耗Na2S2O3溶液20.00mL。通过计算确定镁铁水滑石的化学式______________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补铁剂常用于防治缺铁性贫血,其有效成分一般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是_________(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是_____,碳原子的杂化方式是______;琥珀酸亚铁中存在配位键,在该配位键中配位原子是____,中心原子是____。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
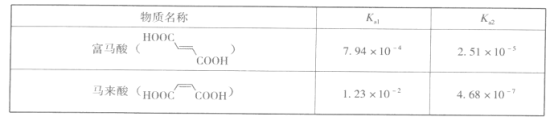
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:____。
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a= 870 pm、b=680 pm、c=479 pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有____种空间取向,晶胞体内硫酸根离子的个数是____,铁原子周围最近的氧原子的个数为____;设阿伏加德罗常数的值为NA,则该晶体的密度是____ g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.SO2与Ba(NO3)2反应生成BaSO3
B.NH3在纯O2中燃烧生成NO2
C.过量CO2与氨水反应生成NH4HCO3
D.高温条件下Fe与水蒸气反应生成Fe(OH)3和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将1mol/L CO和2mol/L 水蒸气混合后发生如下变化:CO(g)+H2O(g) ![]() CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( )
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( )
A. 0.25B. 0.17C. 0.44D. 1.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2分解反应进行实验探究:将质量相等状态不同的MnO2分别加入盛有等体积等浓度的H2O2溶液的大试管中,并用带火星的木条在试管口测试。有关记录如下:
MnO2 | 触摸试管 | 现象 | 反应时间/min |
粉末 | 发烫 | 反应剧烈,带火星的木条迅速复燃 | t1 |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | t2 |
(1)试管中化学反应方程式:____________。
(2)实验结果证明了催化剂的催化效果与____________有关。
(3)表中t1____________t2(填写“>”、“<”或“=”)
(4)控制该反应速率,除了改变催化剂因素,可行的方法还有____________。
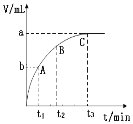
(5)某同学用一定浓度的H2O2溶液10mL,加入适量MnO2在某温度下反应,测量放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是________。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用________(填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是________。
(3)实现步骤④必须用到的两种仪器是________(供选仪器:a. 烧杯;b. 坩埚;c. 蒸馏烧瓶;d. 高温炉;e. 表面皿;f. 锥形瓶)。
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
(NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,______,冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_____至铁屑完全溶解,_____,冷却结晶,用无水乙醇洗涤2~3次,低温干燥。[实验中必须使用的试剂:铁屑、1.0 mol·L-1的Na2CO3溶液、3.0 mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H5IO6(正高碘酸)是用于光度法测定苯肼的试剂。工业上用NaIO3制备H5IO6的流程如图:
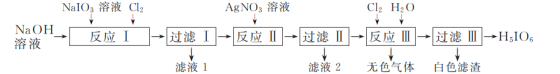
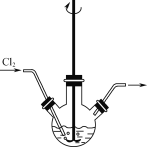
(1)“反应Ⅰ”可在如图所示的装置中进行。该反应生成不溶于水的Na2H3IO6的离子方程式为____。若要提高Cl2的利用率,可对装置进行改进的措施为___。
(2)反应Ⅱ生成不溶于水的黑色Ag5IO6,“滤液2”呈__(填“酸”“碱”或“中”)性。
(3)“无色气体”为__(填化学式)。
(4)工业上为降低成本,减少对环境的污染,整个流程需要控制加入Cl2和AgNO3的物质的量之比为n(Cl2)∶n(AgNO3)=__。
(5)H5IO6具有强氧化性,可将FeSO4氧化为H2FeO4,自身被还原为HIO3,该反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com