
【题目】在一定条件下,将1mol/L CO和2mol/L 水蒸气混合后发生如下变化:CO(g)+H2O(g) ![]() CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( )
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( )
A. 0.25B. 0.17C. 0.44D. 1.0
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A.铁与稀盐酸反应:Fe +2H+ =2Fe2+ + H2↑
B.氢氧化钠溶液与盐酸反应:OH- + H+ = H2O
C.钠与硫酸铜溶液反应:2Na + Cu2+ = 2Na+ + Cu
D.氯化钡溶液与稀硫酸反应:Ba2+ + SO![]() = BaSO4↓
= BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | Cl2(H2O) | 饱和NaCl溶液 | 洗气 |
B | CH3CH2OH(H2O) | CaO | 蒸馏 |
C | FeCl2(FeCl3) | Cu | 过滤 |
D |
| CCl4 | 萃取 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)基态K原子中,核外运动状态不同的电子共________种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K________(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为________,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。
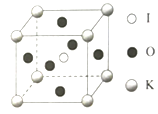
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为________nm,与K紧邻的O的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )
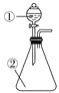
A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
【答案】D
【解析】
A.浓硫酸具有吸水性,浓盐酸具有挥发性,浓硫酸吸收浓盐酸中的水分导致浓盐酸浓度增大而加强其挥发性,浓硫酸和盐酸都是强酸,该实验体现浓盐酸的挥发性和浓硫酸的吸水性,故A错误。
B.常温下浓硫酸和Cu不反应,所以没有明显现象,故B错误。
C.浓硫酸具有吸水性,能吸收五水硫酸铜中的结晶水而使五水硫酸铜变为无水硫酸铜,固体由蓝色变为白色,该实验为化学变化,故C错误。
D.浓硫酸能将有机物中的H、0元素以2:1水的形式脱去而体现脱水性,还能将蔗糖脱水后形成的碳单质. 氧化为二氧化碳.同时还生成刺激性气味的二氧化硫,体现了浓硫酸的强氧化性.故D正确。
答案选D。
【题型】单选题
【结束】
9
【题目】已知NH4NO3在空气中爆炸时的反应为4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
A.NH4NO3在高温下爆炸时可以看到红棕色的烟雾
B.NH4NO3的含氮量小于氯化铵
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com