
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
【答案】A
【解析】
A、淀粉水解时要用硫酸作催化剂,要先用NaOH将混合液中和至弱碱性或中性,再用新制氢氧化铜悬浊液检验,故A正确;
B、实验的原理方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,题中高锰酸钾过量,应设计成:高锰酸钾的物质的量相同,浓度不同的草酸溶液,且草酸要过量,探究反应物浓度对该反应速率的影响,故B错误;
C、要证明甲烷与氯气发生了取代反应,因有氯化氢生成,不能通过体积变化就断定发生取代反应,故C错误;
D、验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ],要先制得Mg(OH)2,再加入少量Cu2+,沉淀转化为Cu(OH)2,沉淀由白色转化成蓝色,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是( )

A.水煤气变换反应的△H>0
B.步骤③的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O·
C.步骤⑤只有非极性键H—H键形成
D.该历程中最大能垒(活化能)E正=2.02eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请同学们仔细阅读下表,并回答下列问题:
元素 | 甲 | 乙 | 丙 |
元素符号 | ① | Cl | O |
原子结构示意图 |
| ② | ③ |
周期 | 三 | ④ | 二 |
族 | ⑤ | ⅦA | ⅥA |
(1)写出①的元素符号___,②的原子结构示意图___,④的周期___,⑤的族___;
(2)甲元素最高价氧化物对应的水化物呈___性(填“酸”或“碱”),乙元素最高价氧化物对应的水化物的化学式为___,甲元素最高价氧化物对应的水化物与乙元素最高价氧化物对应的水化物相互反应的化学方程式为___;
(3)甲与乙两元素的单质反应生成物的电子式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到5.05g沉淀,对样品所含杂质的正确判断是
A. 肯定有Na2CO3,没有Ba(NO3)2 ,可能有有KNO3
B. 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C. 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D. 以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
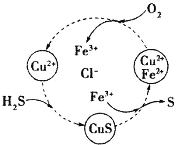
A.在转化过程中化合价不变的元素只有Cu和Cl
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒基固溶体合金是一类重要的贮氢材料。某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、 TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含 VO(OH)2, Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品。制备共沉淀物的装置如下图:
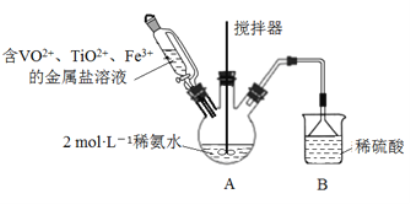
(1)用浓氨水配制500mL2mol·L-l的稀氨水,需用到的玻璃仪器有烧杯、胶头滴管和_____________。
(2)装置B的作用是__________________________。
(3)制备VO2+时,用草酸将VCV还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为__________________________。
(4)反应过程補控制温度为60℃,三颈烧瓶的加热方式是__________________________。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是__________________________。
②若过滤速度较慢,可采用__________________________(填操作名称)
③用无水乙醇洗涤:与水相比,使用无水乙醉洗涤的优点是:__________________________;简述洗涂的具体操作:_______________________________________。
④低温干燥,得共沉淀物。
(6)将(5)所得共沉淀物锻烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g 产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用 0.1000mol·L-1酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁(M=56)的质量分数为______________________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是王水的发现者。下列说法不正确的是( )
2K2O+4NO↑+3O2↑),同时他也是王水的发现者。下列说法不正确的是( )
A.实验室可用KNO3与浓硫酸反应制备少量的HNO3,利用了强酸制弱酸的原理
B.干馏产生的混合气体理论上可被水完全吸收生成硝酸
C.王水溶解金发生的反应中作氧化剂的是硝酸
D.硝石可用来制作黑火药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com