
����Ŀ����������ͭ�Ƚ������仯�������ճ�������Ӧ�ù㷺�����������ʵ��ش����⡣(1)�����к���һ����̼������X(Fe3C)��X�������Ŀ����и������գ������д��ԵĹ���Y����Y���ڹ����������Һ�д������ڵ���������________��Y�����Ũ���ᷴӦ����Һ�к��е��εĻ�ѧʽΪ________��
(2)ij��Һ����Mg2����Fe2����Al3����Cu2�������ӣ������м��������NaOH��Һ���ˣ��������������գ��������պ�Ĺ���Ͷ�������ϡ�����У�������Һ��ԭ��Һ��ȣ���Һ�д������ٵ���������________��
A��Mg2�������� B��Fe2��������
C��Al3�������� D��Cu2��
(3)����������Ҫ�Ĺ�ҵ���ϣ��÷���м�Ʊ������������£�
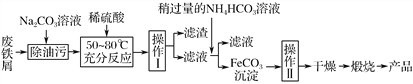
�ش��������⣺
�ٲ�������������________����������������________���������ķ���Ϊ________��
����д������FeCO3���������ӷ���ʽ��___________________________________��
���𰸡�(1)Fe2����Fe3����H��Fe(NO3)3
(2)BC
(3)������ ϴ�� ��©���м�����������ˮ����û������������ˮ��Ȼ���£��ظ�2��3��
��Fe2����2HCO3-=FeCO3����CO2����H2O
��������(1)�����������о��д��Ե���Fe3O4��Fe3O4���ڹ������������Һ�д��ڵ���������Fe2����Fe3����H����Fe3O4���ڹ�����Ũ�����FeԪ�ػᱻ����ΪFe3�������Է�Ӧ�����Һ�к��е�����Fe(NO3)3��(2)�����Һ�м��������NaOH��Һ��Mg2����Mg(OH)2��Fe2����Fe(OH)3��Al3����[AlCO4]����Cu2����Cu(OH)2�����˺������к���Mg(OH)2��Fe(OH)3��Cu(OH)2���������պ�Mg(OH)2��MgO��Fe(OH)3��Fe2O3��Cu(OH)2��CuO����MgO��Fe2O3��CuOͶ��������������Mg2����Fe3����Cu2������Ӧѡ��B��C��(3)��������ͼ��֪�����������õ��������ʸò����ǹ��ˣ����������ڵõ�FeCO3��������еģ��ʸò�����ϴ�ӣ�ϴ�Ӿ����������Ϊ����©���м�����������ˮ����û������������ˮ��Ȼ���£��ظ�2��3�Σ���������ͼ�з��������Թ�����NH4HCO3��Һ����FeCO3��������Ӧ��CO2���ɣ��������ֽⷴӦ�����ӷ���ʽΪ��Fe2����2HCO3-=FeCO3����CO2����H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2S2O3��5H2O����Ϊ��Ч���ȼ�����ҵ����������(FeS2)Ϊԭ���Ʊ������ʵ��������¡�
������
![]()
![]()
![]()
![]()
![]()
 Na2S2O3��5H2O
Na2S2O3��5H2O
��֪����.����A����ʹƷ����Һ��ɫ��������(H2S)����ܻ�õ�����
��.pHԼΪ11�������£����������������ο��Թ���������������Ρ�
�ش��������⣺
��1������¯�н�������������ÿ�������ʹ֮�ﵽ�����ڡ�״̬����Ŀ����_______________________________��
��2���������е�ԭ��B����ѡ��________(����ĸ���)��
a��NaCl��Һ����b��Na2CO3��Һ����c��Na2SO4��Һ
��3��ijС��ͬѧ����ͼװ��ģ���Ʊ�Na2S2O3�Ĺ���(����װ������ȥ)��

��ʹ��70%���������98%��Ũ���ᷴӦ���ʿ죬��ԭ����____________________��װ��B��������______________________��
��C���Ʊ�Na2S2O3������������Ӧ�Ļ�ѧ����ʽ��Na2S��H2O��SO2===Na2SO3��H2S��2H2S��SO2===3S����2H2O (��)2H2S��H2SO3===3S����3H2O��___________________________________��
��4������ʦ����˴��������õ�����Ĺ��գ���������������ù�����ϡ�����ȡ���õ���������������壬�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����

A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijЩ�����ת����ϵ�����ַ�Ӧ���������δ�г�������֪F��һ�ֺ��ɫ������M��K�dz����Ľ������ʣ�B��һ���д̼�����ζ�����壻��C��Һ�м���BaCl2��Һ�����ɲ�����ϡ����İ�ɫ������

��1����֪��X�����ᾧˮ����X�Ļ�ѧʽΪ_________��
��2������������ʧ��G��D��H2O��ǡ����ȫ��Ӧ����I����ӦʱG��D�����ʵ���֮��Ϊ______��
��3������K��I��ϡ��Һ��Ӧ�����ӷ���ʽΪ__________________________��
��4��J��NaOH��Һǡ����ȫ��Ӧ������һ���Ρ������ε�ˮ��Һ�������տɵõ�_________���ѧʽ����
��5����0.02 mol��L-1��X��Һ�У��������ӵ�Ũ���ɴ�С��˳��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� X��Y��Z��W����������һ�������¾�����ͼ��ʾ��ת����ϵ�������ж���ȷ����
![]()
A����ͼ�з�Ӧ��Ϊ��������ԭ��Ӧ����WΪһԪǿ��ʱ����X������NaAlO2
B����ͼ�з�Ӧ��Ϊ��������ԭ��Ӧ����WΪһԪǿ��ʱ����X������NH3
C����ͼ�з�Ӧ��Ϊ������ԭ��Ӧ����WΪ�ǽ�������ʱ����Z������CO2
D����ͼ�з�Ӧ��Ϊ������ԭ��Ӧ����WΪ��������ʱ����Z������FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ャҺ��Al(OH)3��MnO2������Na2CrO4�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ2����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��͢��е����⡣

��������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1����Ӧ�������Լ�NaOH�ĵ���ʽΪ_________��B��C�ķ�Ӧ����Ϊ__________��C��Al���Ʊ�������Ϊ______________��
��2����С��̽����Ӧ�ڷ�����������D��Ũ�����ϣ������ȣ��ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�___________��
a���¶� b��Cl-��Ũ�� c����Һ�����
��3��0.1 mol Cl2�뽹̿��TiO2��ȫ��Ӧ������һ�ֻ�ԭ�������һ����ˮ���TiO2��xH2O��Һ̬���������4.28 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
����Ԫ����Һ�ķ��������
��4���ö��Ե缫���ʱ��CrO42-�ܴӽ�Һ�з��������ԭ����__________�������Ԫ�ص�������_________�����������ɵ�����Ϊ___________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1���� ![]() ��ϵͳ������_______________��
��ϵͳ������_______________��
��CH3CH2CHO��������Ӧ�Ļ�ѧ����ʽ��_____________________��
��2���л���A�Ľṹ��ʽΪ![]() ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E �������ʡ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E �������ʡ�
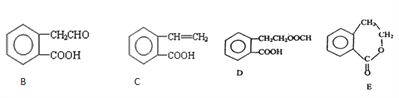
��ش��������⣺
��1��ָ����Ӧ�����ͣ�A��C��_______________ ��
��2����A��E���������У���Ϊͬ���칹�����_______________������ţ���
�ۼ�֪HCHO����������ԭ�Ӷ���ͬһƽ���ڣ������������������е�ԭ���п��ܶ���ͬһƽ���������____________������ţ���
�� C���γɸ߾���ø߾���Ľṹ��ʽΪ��__________________��
�� д��D��NaOH��Һ���ȷ�Ӧ�Ļ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣

��1��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ��Ӧ����ʽ��___________________���ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ���������Ӧ��________��Ӧ��
��2����������ˮԡ���ò���ͬ����������________���ҵ�������________��
��3����Ӧ����һ��ʱ������Թ�a�����ռ�����ͬ�����ʣ����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����________��Ҫ��ȥ�����ʣ������ڻ��Һ�м���________(��д��ĸ)��
a���Ȼ�����Һ��������b���� c��̼��������Һ d�����Ȼ�̼
Ȼ����ͨ��________(��ʵ���������)���ɳ�ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
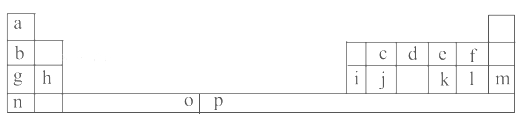
�Իش��������⣺
��1��Ԫ��pΪ26��Ԫ�أ���д����ԭ�ӵ����������ӵĵ����Ų�ʽ��______________��
��2��e��a��Ӧ�IJ���ķ���������ԭ�ӵ��ӻ���ʽΪ__________���÷�����__________(����ԡ��Ǽ��ԡ�)���ӡ�
��3����д��f���⻯����ˮ������������ı���ʽ������д���ּ��ɣ�_________________________��
��4��o��p��Ԫ�صIJ��ֵ��������������±���
Ԫ�� | o | p | |
������ /kJ��mol��1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
�Ƚ���Ԫ�ص�I2��I3��֪����̬o2����ʧȥһ�����ӱ���̬p2����ʧȥһ�������ѡ��Դˣ���Ľ�����___________________________________��
(5)i���ʾ�����ԭ�ӵĶѻ���ʽ����ͼ����ʾ���侧����������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ����ͼ����ʾ��
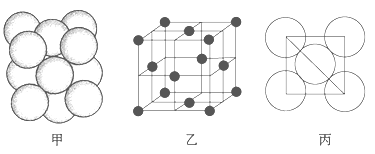
���ʾ�����iԭ�ӵ���λ��Ϊ________��һ��������iԭ�ӵ���ĿΪ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com