
【有机物化学基础】
图中A、B、C、D、E、F、G均为有机化合物根据图回答问题

(1)A、B的相对分子质量之差是 ,B可能的结构简式 ;
(2)上述转化关系属于取代反应类型的是(用序号表示) ;
(3)写出反应③、⑤的化学方程式: 、 ;
(4)B的同分异构体有多种,其中同时符合下列条件的同分异构体有 种,写出其中任一种的结构简式 。
①是苯环的二元取代物
②与NaHCO3反应产生无色气体
③与FeCl3溶液显紫色
(1)70 
(2)①②③
(3)③CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
⑤ CH3CHO+2Ag(NH3)2OH  CH3COONH4+2Ag+3NH3↑+H2O
CH3COONH4+2Ag+3NH3↑+H2O
(4)3  (或
(或 、
、 )
)
【解析】由转化关系图可知,D为CH3CH2OH,D与C反应生成F为酯化反应,F为C4H8O2,则C为CH3COOH,B发生酯化反应生成环酯,A中12个碳原子,则B中含8个C原子,含-OH和-COOH,其可能的结构简式为 ,分子式为C8H8O3,D反应生成E,E为CH3CHO,E反应生成G,G为CH3COOH,反应①为水解反应,反应②为酯化反应,反应③为酯化反应,反应④为氧化反应,反应⑤为氧化反应
,分子式为C8H8O3,D反应生成E,E为CH3CHO,E反应生成G,G为CH3COOH,反应①为水解反应,反应②为酯化反应,反应③为酯化反应,反应④为氧化反应,反应⑤为氧化反应
(1)A为C12H14O4,B为C8H8O3,相对分子质量之差为12×4+6+16=70,B可能为 。
。
(2)反应①为水解反应,反应②为酯化反应,反应③为酯化反应,均属于取代反应,故答案为:①②③。
(3)反应③为③ CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
反应⑤ CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag+3NH3↑+H2O
CH3COONH4+2Ag+3NH3↑+H2O
(4)B为C8H8O3,符合①②③条件的说明含有酚羟基、羧基,故结构可能为 、
、 、
、 ,共3种。
,共3种。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源:2014高考名师推荐化学乙醇和乙酸(解析版) 题型:选择题
下列化学方程式书写错误的是
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:
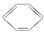 +HNO3(浓)
+HNO3(浓)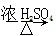
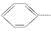 NO2+H2O
NO2+H2O
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH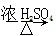 CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.乙烯使溴的四氯化碳溶液褪色: CH2CH2+Br2 CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp的计算及有关图像的分析(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)  2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。

(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ?
? CaCO3(s)+
CaCO3(s)+
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子 | NO | SO42- | H+ | M |
浓度(mol·L-1) | 2 | 1 | 2 | 1 |
A.Mg2+ B.Ba2+ C.F- D.Na+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:实验题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4 氧化Fe2+的离子方程式补充完整:
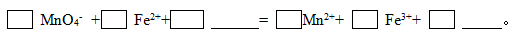
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的 。
(4)己知:一定条件下,MnO4- 可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
②Ⅳ中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态
C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍
D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列实验操作、现象和解释都正确的是
选项 | 实验操作 | 现象 | 解释 |
A | 在密闭容器中加热CuO | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列分类正确的是
A.共价化合物:硫酸、水、纯碱
B. 非电解质:乙醇、二氧化碳、氨气
C. 胶体:饱和氯化铁溶液、豆浆、牛奶
D.硅酸盐产品:水晶、玻璃、陶瓷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol·L-1的KNO3溶液:Cl-、SO42-、H+、Fe2+
B.c(H+)=1.0×10-12mol·L-1的溶液:K+、Na+、CH3COO-、Br-
C.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com